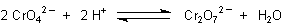
Das Chromat / Dichromat-Gleichgewicht
Experimente:
Versuch: Das Chromat / Dichromat-Gleichgewicht
Wie alle Chromverbindungen sind auch die des sechswertigen Chroms, die
Chromate, intensiv gefärbt. Eine verdünnte Lösung von gelbem Chromat CrO42-
enthält stets orangefarbene Dichromat-Ionen Cr2O72- (und umgekehrt). Das weist
darauf hin, dass sich in der Lösung zwischen den beiden Anionen ein Gleichgewicht
einstellt.
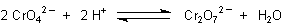
(Genau genommen stehen Hydrogenchromat-Ionen HCrO4- mit den Dichromat-Ionen im Gleichgewicht.)
Die Gleichgewichtskonstante ist K = 102,2.
Dieses Gleichgewicht kann durch Zusatz von Säure oder Base willkürlich nach links oder rechts verschoben werden. Das ist eine der Folgerungen aus dem Le Chatelierschen Prinzip. Dabei gibt es charakteristische Farbvertiefungen von Gelb nach Orange bis Rot.
Bei konzentrierteren Säurelösungen bilden sich auch höhere Chromate wie zum Beispiel Tri- oder Tetrachromate. Mit konzentrierter Schwefelsäure bildet sich tiefrotes polymeres Chrom(VI)-oxid CrO3. Diese Mischung ist unter dem Namen Chromschwefelsäure bekannt; sie wird im Labor aufgrund ihrer starken Oxidationskraft zum Reinigen von stark verschmutztem Laborgerät genutzt. Ihr Nachteil ist, dass man anschließend Entsorgungsprobleme hat.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“