
Das Prinzip von Le Chatelier: Gleichgewichte lassen sich verschieben
Experimente:
Versuch: Das Chromat / Dichromat-Gleichgewicht
Versuch: Gasreaktionsgleichgewichte: Das
NO2/N2O4-Gleichgewicht
Versuch: Temperaturabhängigkeit der Bildung des Iod/Stärke-Komplexes
Versuch: Löslichkeitsgleichgewicht von Bleiiodid
Man kann vielfältig auf Gleichgewichte einwirken. Das wirkt sich primär als Störung
aus. Bei solchen Störungen stellt sich das Gleichgewicht dann neu ein. Dies
geschieht, indem entweder die Hin- oder die Rückreaktion verstärkt abläuft.
Dahinter steckt ein wichtiges Prinzip: Übt man auf ein Stoffgemisch, das sich im
chemischen Gleichgewicht befindet, einen äußeren Zwang aus, so weicht es
diesem äußeren Zwang aus ("Gesetz vom kleinsten Zwang"). Es wird immer die
Reaktion begünstigt, mit der dem äußeren Zwang am besten entgegengewirkt werden
kann.
Dieses Prinzip wurde von Henry Le Chatelier 1884 formuliert und nach ihm benannt:
Was die Formulierung „kleinster Zwang“ bedeutet, erklären wir unten.
Zwang ausüben kann man durch Temperaturänderung, Druckänderung und
Konzentrationsänderung
Die folgende Tabelle gibt einen Überblick über die Möglichkeiten, durch äußeren
Zwang auf ein Gleichgewicht einzuwirken.

(Quelle: Cornelsen)
Beispiel Ester-Synthese/Hydrolyse-Gleichgewicht
Ein klassisches, im Unterricht quantitativ demonstrierbares Beispiel
ist das Estergleichgewicht.
Bildung und Zerfall von Essigsäureethylester werden durch die folgende Reaktionsgleichung beschrieben:
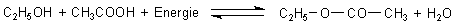
(Es ist zu empfehlen, zur Erleichterung der Diskussionen bei deutlichem Wechsel des Energie-Inhaltes die Energie als Reaktionspartner mit in die Reaktionsgleichungen aufzunehmen. Abkühlen bedeutet Entfernen der Energie, Erwärmen bedeutet Zufuhr an Energie.)
Zunächst kann man mit den Konzentrationen der Reaktanden spielen.
Wenn man dem Gemisch aus Alkohol, Säure, Ester und Wasser noch etwas Alkohol
oder Säure hinzufügt, wird die Bildung von Ester und Wasser begünstigt. Durch die
Esterbildung werden Alkohol und Säure verbraucht.
Die gleiche Wirkung hat der Entzug von Ester und Wasser. Das kann man z. B.
dadurch erreichen, dass man das Gemisch erwärmt und den (im Allgemeinen am
niedrigsten siedenden) Ester abdestilliert.
Eine Temperaturerhöhung bewirkt Esterspaltung.
Eine Druckänderung wirkt sich beim Estergleichgewicht nicht aus, da sich das Volumen nicht ändert. Das ist nur bei Gleichgewichten der Fall, bei denen Gase entstehen oder verschwinden. Beispiel: HCl / NH3 / NH4Cl-Gleichgewicht (siehe unten).
In den Texten zur Webseitensammlung zum Chemischen Gleichgewicht stellen wir weitere Beispiele für dieses wichtige Prinzip vor. Hilfreich ist auch ein Suchbefehl "Le Chatelier" in unserer serverinternen Suchmaschine, anzuklicken auf der Startseite unserer Homepage.
Was bedeutet eigentlich die Formulierung „Prinzip vom kleinsten Zwang“?
Wenn sich Lernende in das Prinzip von Le Chatelier hineindenken, gibt es wegen dieser Formulierung
immer Verständnisschwierigkeiten: „Gesetz vom kleinsten Zwang". Was ist das, der „kleinste Zwang“? Hierzu die
Anfrage eines genervten Lehrers:
F: Ich habe da ein kleines Problem und hoffe auf Ihre Hilfe: Oft lese ich in den Büchern: "Prinzip vom kleinsten Zwang“. Auch Sie benutzen auf Ihrer Seite diese Formulierung. Was aber ist mit dem "kleinsten" eigentlich gemeint und wäre es nicht sinnvoller vom "Prinzip vom Zwang" zu sprechen (was ich auch oft lese). Unter "Zwang" verstehe ich eine Intervention von außen ("Übt man einen Zwang aus ...") und das System reagiert doch auf alle Zwänge, oder? Und überhaupt kommt der Begriff "kleinste" in der eigentlichen Definition gar nicht vor (s. o.)!! Kann man irgendwo den Originaltext einsehen? Vielleicht würde das weiterhelfen. Natürlich würde ich selbst es gerne verstehen. Es ist aber auch wegen der Fragen meiner SchülerInnen: "Wieso steht da kleinste?". (Ich bin Lehrer.) Und dann muss ich leider passen - wegen des Superlativs. Und das finde ich dann doch ziemlich doof. Haben alle voneinander abgeschrieben ("kleinster Zwang") oder hat der alte Le Chatelier sich doch etwas dabei gedacht? Hilfe!!! Lg … PS: Ich hoffe, Sie verstehen mein Problem. Ich hab's im chemieonline forum probiert, aber auf solche Fragen scheinen die da nicht zu stehen, oder ich kann mich nicht richtig „quetschen aus“. |
Es handelt sich bei der Bezeichnung „Gesetz vom kleinsten Zwang“ um eine griffige Formulierung eines eher umständlich zu beschreibenden Gegenstands. Besser wäre es, wenn man nur vom Prinzip von Le Chatelier sprechen würde - was ja auch allgemein gemacht wird.
Man sollte besser vom Gesetz von der Minimierung der Zwangwirkung sprechen, oder wenn auch etwas umständlicher vom Gesetz von der Minimierung der Wirkung eines von außen einwirkenden Zwangs auf ein Gleichgewichtssystem.
Dann lautet das Gesetz folgendermaßen:
Übt man auf ein System im Gleichgewicht einen Zwang aus, so verschiebt sich das System so in Richtung auf eine neue Gleichgewichtslage, dass die Wirkung des Zwangs minimal wird, also am kleinsten ist.
Der Begriff „Minimum“ ist durchaus im Sinne eines mathematisch definierbaren Minimums (Differentialrechnung!) zu verstehen!
Übt man z. B. auf eine Gas-Gleichgewichtsreaktion wie z. B.
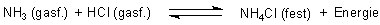
einen Zwang (hier: Druck) aus, so wird die Wirkung des Zwangs/Drucks am kleinsten (minimiert), wenn die Gase zu Gunsten der Bildung eines Festkörpers verschwinden, also die Reaktion nach rechts verläuft. Übt man den Zwang/Druck weiterhin aus, so passiert nichts mehr. Seine Wirkung ist nun minimal geworden - eben am kleinsten.
Das Prinzip von Le Chatelier spielt auch in anderen Wissenschaften eine Rolle
Ich habe übrigens die ziemlich schwierig zu lesenden Originalschriften eingesehen: Der Chemiker Le Chatelier (1850-1936)
hat seine Ideen wohl ausgehend von der Gesellschaftswissenschaft her formuliert. Er war also gleichzeitig ein Soziologe… Seine Texte
spielen deshalb auch in dieser Wissenschaft eine Rolle. Oder auch in der Pädagogik: Schüler arbeiten nur dann, wenn der Zwang (z. B.
einer bevorstehenden Klassenarbeit) droht. Nachdem der Zwang ausgeübt wurde (d. h. die Arbeit geschrieben wurde), tun sie nichts mehr
- obwohl der Zwang weiter besteht. Denn die nächste Klassenarbeit droht…
Anzumerken ist noch, dass das Prinzip auch in anderen, naturwissenschaftlichen Wissenschaftsbereichen wie Biologie (Steuerung von Ökosystemen) eine Rolle spielt.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“