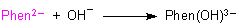
Das Phenolphthalein-Molekül in stark alkalischem Milieu:
Die Carbinolbildung
Experimente:
Versuch: Entfärbung von Phenolphthalein in Natronlauge
In stark alkalischem Milieu (pH > 12) greift ein Hydroxid-Ion das zentrale sp2-C-Atom an.
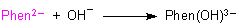
Es bildet sich im Verlauf dieser nucleophilen Additionsreaktion ein Carbinol, dessen zentrales C-Atom wieder sp3-hybridisiert ist. Das Molekül ist nicht mehr planar und das bedeutet Entfärbung.
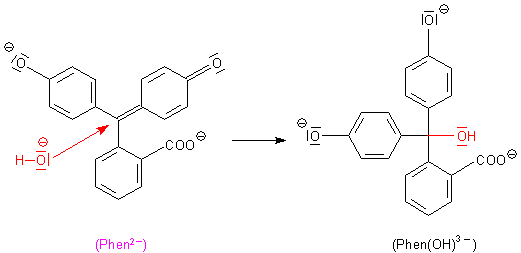
Reaktion in übermäßig stark alkalischem Milieu
(Bildung der farblosen Carbinolform)
Bei Säurezugabe wird das Hydroxid wieder abgespalten und das Di-Anion bildet sich zurück, so dass die Lösung
sich langsam wieder purpurn färbt.
Die Reaktionsgeschwindigkeit der Entfärbung ist proportional zur Konzentration an Hydroxid-Ionen. Mit Steigerung
des pH-Werts um 1 nimmt die Geschwindigkeit um den Faktor 10 zu.
In diesem Zusammenhang sei an die gleichen Reaktionen von Kristallviolett
erinnert, dem Klassiker zur Untersuchung des Ablaufs von Reaktionen (Pseudo)-Erster
Ordnung. Da das Arbeiten mit Kristallviolett in der Schule mittlerweile verboten ist, kann man stattdessen
Phenolphthalein zur Untersuchung der reaktionskinetischen Abläufe verwenden.
Ähnliche Entfärbungsreaktionen beobachten wir auch bei der Chemie der Tintenkiller. Hier sind allerdings Hydrogensulfit-Ionen die nucleophilen Angreifer auf das zentrale C-Atom.
Weitere Texte zum Phenolphthalein