Was sind Carbonylverbindungen?
Vorstellung einer besonderen Stoffklasse
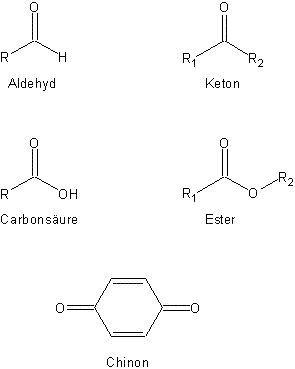
Es gibt verschiedene Verbindungen, die zu dieser Stoffklasse gehören.

Übersicht über verschiedene Carbonylverbindungen
Wenn man die Struktur dieser Carbonylverbindungen betrachtet, dann fällt eine Gruppe ins Auge, die in jeder Verbindung dieser Stoffklasse auftaucht: Die Doppelbindung zwischen einem Kohlenstoff- und einem Sauerstoffatom. Diese Konstellation gab der Stoffklasse ihren Namen, denn es handelt sich hierbei um die Carbonylgruppe.
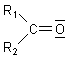
Betrachtet man deren Eigenschaften, so scheint die Carbonylgruppe das Einzige zu sein, was sie verbindet. Ihr Charakter und damit auch die Art und Weise, wie sie unter bestimmten Umständen reagieren, sind zum Teil sehr verschieden. Trotzdem zählen diese Verbindungen alle zu der Gruppe der Carbonyle.
Die Carbonylgruppe
Innerhalb der Sauerstoff-Kohlenstoff-Doppelbindung findet eine Polarisierung statt, die auf
der unterschiedlichen Elektronegativität der beiden Elemente beruht. Da die Elektronegativität
des Sauerstoffatoms größer ist als die des Kohlenstoffatoms, zieht dieses die Elektronen stärker
zu sich heran, wodurch eine Polarisierung erfolgt. Durch die leicht negative Ladung am
Sauerstoffatom wird dieses leicht nucleophil ("Kern liebend") und das
Kohlenstoffatom elektrophil ("Elektronen liebend").
Die Verschiebung der Bindungselektronen spielt beispielsweise bei der Reaktivität der Verbindungen eine entscheidende Rolle. Vor allem finden wir den Reaktionstyp der Addition.
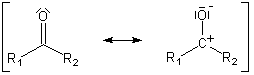
Mesomere Grenzstruktur von Aldehyden (R2 = H) und Ketonen
Häufig wird bei der Formulierung von Reaktionsmechanismen auf die unterschiedlichen mesomeren Grenzstrukturen zurückgegriffen. Das Sauerstoffatom hat in dieser Darstellung das Bindungselektronenpaar ganz zu sich herübergezogen. Dadurch trägt das Kohlenstoffatom die gesamte positive und das Sauerstoffatom die gesamte negative Ladung. Die Polarisierung wird dadurch greifbarer.
Für Spezialisten sei angemerkt, dass es sich bei den Molekülorbitalen der beiden an der Bindung beteiligten Atome um eine sp2-Hybridisierung handelt. Damit liegt eine planare, trigonale Struktur vor. Die Bindung besteht aus einem s- und aus einem p-Anteil. Deshalb ähneln die Verhältnisse denen beim Ethen, nur dass hier die Elektronen stärker zum Sauerstoffatom hin verschoben sind.
Diese Polarisierung hängt aber von der Umgebung der C=O-Gruppe ab. Bei Carbonsäure, Carboxylat-Anion und Ester ist wegen der Elektronenhäufung um das C-Atom die Polarität geringer. Hinzu kommt die Stabilisierung der R-COO-Gruppierung durch Mesomerie zwischen den drei beteiligten Atomen O-C-O. Beim Keton verringert sich die Polarität durch den (+I)-Effekt der beiden Alkylgruppen. Somit entpuppen sich die Aldehyde als die reaktivsten Carbonylverbindungen. Von diesen ist der Formaldehyd wegen seiner zwei H-Atome noch der reaktivste.
Wir befassen uns in der vorliegenden Webseitengruppe nur mit den Aldehyden und Ketonen (bzw. Chinonen).
Die Carbonsäuren und die Ester werden in einem anderen Zusammenhang besprochen. Klicke z. B. hier:
Carbonsäuren:
Ester:
Weitere Texte zum Thema „Aldehyde und Ketone“