Prof. Blumes Tipp des Monats Juni 2005 (Tipp-Nr. 96)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Klick mich an!
Bild 1: Rote Waldameisen
(Foto: Blume)
Ameisen leben gefährlich! -
Denn sie produzieren Ameisensäure (C)
Es ist bald wieder Sommer, und kleine Krabbler stören allerorten. Da sind vor allem die Ameisen. Die nerven einen ganz schön. Denn sie stechen, beißen und spritzen sogar noch einen ätzenden Saft in die Wunden. Trotzdem: Manche Leute breiten ihre Taschentücher über die Nester und schnuppern dann verzückt daran: Die riechen so schön nach Frische! Na ja - für mich riechen die Tücher nach scharfem Essig. Das ist nicht jedermanns Geschmack...

Bild 2: Ameisenhaufen im Tannenwald (Foto: Blume)
Essig? Das klingt nach Säure. Was da abläuft, können wir deshalb auch
mit einem Indikatorpapier untersuchen - z. B. mit einem selbst gemachten mit
Rotkohlsaft als Indikator.
|
Versuch 1: Ameisen verspritzen Säure
|
Klick mich an!
Bild 3: Feuchtes pH-Papier nach wenigen Sekunden auf einem Ameisenhaufen
(Foto: Blume)
Tatsächlich, die kleinen Ameisenspritzer entpuppen sich als Säure, Ameisensäure.
Die wird von Ameisen produziert, um damit Feinde abzuwehren. Deshalb spritzen
sie auch mit vereinten Kräften gegen das Filterpapier mit dem Indikator! Die Säurewaffe
wird auch gegen andere Ameisenvölker eingesetzt, wobei sie untereinander einen
regelrechten chemischen Krieg führen.
Ameisensäure ist flüssig und siedet - wie Wasser - bei 100 °C. Früher hat man sie auf rustikale Art und Weise gewonnen, indem man ganze Ameisenvölker in einen Destillierkolben sperrte und dann komplett destillierte. (Darüber berichten wir auf einer gesonderten Webseite). Wie man sie heute technisch herstellt, lies hier.
Ameisensäure gilt als Naturprodukt. Aber ist sie deswegen ungefährlich? Die folgende Meldung war vor einiger Zeit zu lesen:
 |
Ameisensäure: Drei Menschen verätzt
Drei Menschen wurden durch austretende Ameisensäure schwer verletzt. Beim Aufräumen eines Kellers entdeckten zwei Frauen einen Glasballon, der mehrere Liter Ameisensäure enthielt. Wenige Minuten später zerknallte das Glasgefäß ohne Vorwarnung. Die Säurespritzer verätzten die Haut, austretende Dämpfe griffen die Atemwege an. Ein Rettungssanitäter wurde bei der Versorgung der Frauen verletzt. Die Reste der Ameisensäure wurden von der Feuerwehr unter "Vollschutz" beseitigt. Es handelte sich bei dem Glasballon um die Hinterlassenschaft eines Imkers. |
 |
Die Ameisensäure hat die Formel HCOOH und ist die einfachste Carbonsäure. Sie wird zwar nur zu den schwachen Säuren gezählt. Mit dieser Kennzeichnung beschreibt man jedoch nur ihre unvollständige Dissoziation in wässrigen Lösungen. Als Reinstoff ist sie stark ätzend und gehört zu den Gefahrstoffen mit dem Gefahrensymbol C, mit denen nur unter größter Vorsicht umgegangen werden sollte. Sagenhaft ist auch ihr stechender Geruch.
Ameisensäure wirkt aber auch in verdünnten wässrigen Lösungen noch bemerkenswert aggressiv.
|
Versuch 2: Säure-Eigenschaften der Ameisensäure
|
Alles weist auf das Vorliegen einer stark wirkenden Säure hin. Nutzt man sie beispielsweise des Öfteren zum Entkalken von Kaffeemaschinen, so muss man diese bald entsorgen - weil Ameisensäure alles Metallische angreift.
Ameisensäure wirkt zehnmal stärker als Essigsäure. Man drückt das durch den logarithmischen pKs-Wert aus (Ameisensäure pKs = 3,77; Essigsäure pKs = 4,76).
Ameisensäure ist ein Reduktionsmittel
Noch ein anderer interessanter Aspekt sei erwähnt: Ameisensäure ist nicht nur
die stärkste in der homologen Reihe der einfachen Carbonsäuren. Je nachdem, wie
man die Strukturformel schreibt, wird deutlich, dass es sich bei der
Ameisensäure um eine Carbonsäure handelt, die zugleich aber auch ein Aldehyd
ist.
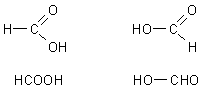
Strukturformeln von Ameisensäure
Ameisensäure wirkt also nicht nur als Säure, sondern auch wie ein Aldehyd und somit als Reduktionsmittel. Der klassische Nachweis für Aldehyde, die Fehlingprobe, verläuft allerdings negativ. Stärkere Oxidationsmittel sind dagegen wirksam.
|
Versuch 3: Reduzierende Eigenschaften von Ameisensäure
B Zu einer verdünnten Lösung von Kaliumpermanganat (w = 3 %) (Xn) tropfst
du etwas Ameisensäure (C).
C Zu einer verdünnten Lösung von Kaliumchromat (w = 0,1 %) (Xn) tropfst du etwas
Ameisensäure und erwärmst im Wasserbad.
|

Bild 4: 1 Ammoniakalische Silbernitratlösung und Natriumformiat
2 Ammoniakalische Silbernitratlösung und Ameisensäure
3 Kaliumpermanganat und Ameisensäure
(Foto: Daggi)

Bild 5: Kaliumchromatlösung und Ameisensäure (Foto: Daggi)
Die Oxidationsgleichung der Ameisensäure ist
HCOOH ———> CO2 + 2 H+ + 2 e-
Außerdem brennt sie hervorragend.
2 HCOOH + O2 ———> 2 CO2 + 2 H2O
|
Versuch 4: Ameisensäure brennt
|

Bild 6: (Foto: Daggi)
Ist CO das Anhydrid der Ameisensäure?
Die Oxidationsstufe +II des C-Atoms in der Ameisensäure entspricht der von CO. Man
könnte also vermuten, dass CO das Säureanhydrid der Ameisensäure ist - so wie
das CO2 bei der Kohlensäure.
Tatsächlich kann man CO aus Ameisensäure herstellen,
indem man konzentrierte Schwefelsäure einwirken lässt. Die entreißt der Ameisensäure Wasser. Gefördert
wird die Reaktion durch Wärmezufuhr.
HCOOH ———> H2O + CO
|
Versuch 5: Kohlenstoffmonoxid aus Ameisensäure
|
Die Wasserabspaltung ist nicht rückgängig zu machen, so dass man beim CO auf keinen Fall vom Anhydrid der Ameisensäure sprechen sollte.
Nun zu dem Unfall
Bei der eben demonstrierten Zersetzung der Ameisensäure spielen Protonen die
Rolle von Katalysatoren.
Ameisensäure ist aber auch ohne Schwefelsäure bemerkenswert instabil. Sie
katalysiert nämlich ihre eigene Zersetzung. Das geht erst langsam los, es
bildet sich aber Wasser, das führt zur Freisetzung von Protonen aus der bislang
undissoziierten Ameisensäure. Die katalysieren den weiteren Zerfall. Damit entstehen
immer mehr Protonen - und so weiter. Das Ganze schwillt dann lawinenartig an. Wir
kennen solche Vorgänge unter dem Begriff Autokatalyse.
Die Zersetzung wird außer durch Wärme noch durch Strahlungsenergie, also durch Licht gefördert. Aus diesem Grunde muss man Ameisensäure in dunklen Gefäßen aufbewahren.
Durch das freigesetzte CO-Gas baut sich im Gefäß ein Druck auf, der schließlich zum Platzen führt - wie im oben beschriebenen Unfall. Offenbar hatte sich ein hochgradig metastabiles System gebildet, dass es durch den kleinen Anstoß beim Hantieren sowie Belichtung zur Explosion kommen musste. Das ist so, als wenn man eine auf dem Rand stehende Münze anstößt. (Übrigens beobachtet man das Gleiche bei konzentrierter Salpetersäure! Auch die kann spontan explodieren.)
Bleibt noch zu fragen, was ein Imker mit Ameisensäure macht
Die Substanz hat nicht nur eine stark bakterizide Wirkung, die sie und ihre
Salze zu einem hochgeschätzten Konservierungsmittel macht. Ameisensäure wirkt
auch gegen Milben - vor allem gegen die Varroa-Milbe. Geben Sie einmal in die
Google-Suchmaschine die beiden Worte Imker Ameisensäure ein.
Sie werden staunen, dass sich vor allem Öko-Imker rühmen, nicht mit chemischen Stoffen,
sondern mit 60%iger Ameisensäure gegen die Milbe vorzugehen. Hier ein Beispiel:
| Expertenrat->Essen und Geniessen->Öko-Imker
... Chemische Behandlungsmittel sind für Öko-Imker tabu. Organische Säuren (z. B. Ameisensäure) sind die ökologischen Alternativen zur Behandlung der Varroamilbe... |
Dagegen wäre ja auch nichts zu sagen - aber angesichts der Unfallmeldung oben klingt das mit dem Öko schon ein bisschen wie Hohn. Andere Imker nehmen übrigens statt dessen Oxalsäure. Die ist als Xn-Stoff auch nicht besonders gesund!
Ziehen wir daraus Lehren für die Imker
Sie müssen mit ihren Säurevorräten vorsichtig umgehen, davon möglichst wenig
bunkern, vor allem nichts Hochprozentiges.
Last but not least sollten Imker dementsprechend auch ihre Nachlässe regeln...
| Klick mich an! |
 |
| Bild 7: Diese Ameise bekämpft mutig einen Marienkäfer
(Foto: Blume) |
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 11. April 2012, Dagmar Wiechoczek

