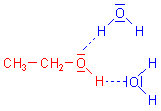
Was Wasser und Ethanol verbindet: Wasserstoffbrücken
Experimente:
Versuch: Wenn man Wasser und Alkohol mischt
Versuch: Trennung von Ethanol und Wasser durch Aussalzen
Wasser und Alkohol haben gewisse strukturelle Ähnlichkeiten. So kann man sich beim Wassermolekül
ein H-Atom durch einen Ethylrest ersetzt vorstellen, und schon haben wir das Molekül des Ethanols.
Wie Wasser kann auch das Ethanol H-Brücken aufbauen.
Nun sollte man meinen, dass die H-Brücken zwischen Alkoholmolekülen aufgrund des elektronenschiebenden (+I)-Effekts der Alkylgruppe stabiler sein sollten; aber dadurch wird die Auslenkung der Hybridorbitale des Sauerstoffatoms verringert, wodurch auch das an H-Brücken beteiligte H-Atom näher an das Alkoholmolekül gezogen wird und deshalb nicht so leicht abgeht.
Hinzu kommen auch sterische Effekte, denn die Ethylgruppe behindert das Andocken eines externen H-Atoms an den Sauerstoff.
Immerhin können wir jetzt die Löslichkeit des Alkohols in Wasser erklären. Nur sind die Brücken nicht ganz so fest wie zwischen Wassermolekülen.

Und wie sieht es mit der Löslichkeit der Ethylgruppe aus? Wassermoleküle bilden um diese herum einen Hydratkäfig, der die Ethylgruppe abschirmt. Das zeigt sich deutlich, wenn man gleiche Mengen an Alkohol und Wasser mischt. Denn dabei erkennt man sogar eine Volumenverringerung. Dieser Vorgang ist erwartungsgemäß exotherm, das heißt, die Mischung erwärmt sich (-> Versuch). Der Grund: Die vorher beweglichen Wassermoleküle werden dadurch ausgebremst. Sie geben ihre Energie an die freien Wassermoleküle oder an die gesamten Käfige ab, die sich dadurch schneller bewegen.
Für Fachleute: Hierbei nimmt die Entropie ab. Somit sind diese Strukturen nicht sonderlich stabil. Durch Zusatz von Inertsalzen kann man den Vorgang der Käfigbildung rückgängig machen (-> Versuch). Dann kann der Ethylrest seine wasserfeindliche Rolle voll ausspielen.
Weitere Texte zum Thema „Alkohol“