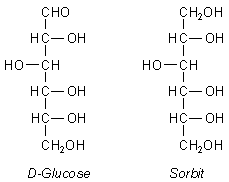
Der Zuckeralkohol Sorbit
Experimente:
Versuch: Vergleichende Untersuchung von Glucose und Sorbit
Von Sorbit habt ihr sicherlich schon oft gelesen. Zumindest wenn ihr euch das Kleingedruckte auf
der Liste der Inhaltsstoffe eurer Kaugummis oder Lutschbonbons einmal durchgelesen habt. Denn hier
ist die Wahrscheinlichkeit sehr hoch, Sorbit anzutreffen. Oft wird diese Verbindung auch als
Sorbitol bezeichnet, oder es ist nur die E-Nummer
E 420 angegeben.
Was ist Sorbit überhaupt?
Vom Aufbau her betrachtet, ist diese Verbindung dem Glucosemolekül sehr ähnlich (->
Versuch).
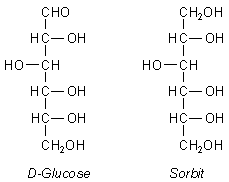
Aufbau von Sorbit und Glucose im Vergleich
Auch hier ist die Anordnung der Hydroxylgruppen nach dem Schema "ta-tü-ta-ta", also rechts-links-rechts-rechts. Der einzige Unterschied liegt darin, dass anstatt der Aldehydgruppe der Glucose Sorbit an dieser Stelle eine weitere Hydroxylgruppe trägt. Man beobachtet mit Sorbit auch keine Reaktion mit Fehling-Reagenz. Also ist Sorbit - trotz gewisser struktureller Ähnlichkeit - kein Zucker. Es reagiert aber positiv mit Cerammoniumnitrat-Reagenz, was bedeutet, dass es sich tatsächlich um einen Alkohol handelt, und zwar um einen sechswertigen. Da er aber aus einem Zucker gemacht wird, spricht man beim Sorbit von einem Zuckeralkohol.
Sorbit reiht sich somit in die Gruppe der Polyole ein. Er ist ein Feststoff, der sich sehr gut in Wasser löst (70 g/100 g Wasser bei 20 °C). Außerdem ist er wie alle Polyole hygroskopisch.
Die Synthese von Sorbit
Da Sorbit der Glucose so ähnlich ist, kann er natürlich einfach aus diesem Zucker hergestellt
werden. Dafür muss lediglich die Carbonylgruppe reduziert werden. Als Reduktionsmittel dienen in der
Industrie Wasserstoff und ein Nickel-Katalysator; im Labor nimmt man Natriumborhydrid.
Wo ist überall Sorbit versteckt?

Beeren der Eberesche (Foto: Blume)
Ursprünglich hat man Sorbit aus den Früchten der Eberesche (Sorbus aucuparia), den roten Vogelkirschen, gewonnen. Auch in einigen Früchten wie Pflaumen, Kirschen oder Pfirsichen kommt der Zuckeralkohol vor.
Seine Anwendung ist sehr weit. Vor allem in der Lebensmitteltechnologie oder in der Kosmetik wird Sorbit eingesetzt.
In der Lebensmittelherstellung wie beispielsweise bei Senf, Ketchup, Mayonnaisen, Toasts sowie bei Süßwaren, Marinaden und Dressings dient es als Feuchthaltemittel. Sorbit schützt die Nahrungsmittel aufgrund seiner hygroskopischen Eigenschaften vor dem Austrocknen.
Außerdem schmeckt Sorbit durch die große Anhäufung der Hydroxylgruppen sehr süß. Deshalb dient er als Süßungsmittel. Man setzt ihn auch Wein oder Bier zu. Zwar hat Sorbit nur die halbe Süßkraft von Saccharose, dafür wirkt er aber nicht kariesfördernd. Und im Gegensatz zu vielen anderen Zuckerarten wird kein Insulin im menschlichen Organismus benötigt, um das Sorbit zu resorbieren oder abzubauen, und kann besonders als Diabetiker-Zuckerersatzstoff verwendet werden.
Eisbonbons fühlen sich auf der Zunge kühl an. Das liegt an der hohen Lösungswärme des Sorbits, denn zum Lösen in Wasser braucht der Feststoff Energie, die der warmen Zunge entzogen wird.
Vorsicht, zuckerfrei!
Mit Ausnahme von Getränken ist Sorbit in fast allen Lebensmitteln in beliebig großer Menge zugelassen. Und
das obwohl mehr als 20 g pro Tag davon zu Blähungen, Bauchschmerzen und Durchfall führen. Wenn man das
Kleingedruckte nämlich weiter liest, findet man auch den Wortlaut: "...kann bei übermäßigem Verzehr abführend
wirken."
Ein Grund dafür betrifft Menschen mit einer Fructose-Intoleranz. Für sie weisen Zuckeralkohole einen gravierenden Nachteil auf, denn Sorbit blockiert das Transportsystem, welches die Fructose abbauen soll. Es dockt sich an das Transportprotein an und es kommt zu einer Stilllegung der Fructose-Verdauung. Dann treten selbst bei geringen aufgenommenen Mengen Beschwerden auf, die zu Durchfall und Magenkrämpfen führen können.
Der Packungshinweis "zuckerfrei" ist sehr oft schon ein Hinweis darauf, dass Sorbit statt Zucker enthalten ist. Man sollte aus gegebenen Gründen darauf achten, nicht allzu viele solcher Produkte zu sich zu nehmen.
Weitere Texte zum Thema „Alkohol“