Wie hängt die Geschwindigkeitskonstante von der Temperatur ab?
Jeder weiß, dass viele chemische Reaktionen durch Erwärmung des Reaktionsgemischs gefördert werden, d. h. die Reaktionsgeschwindigkeit nimmt zu. Die Q10-Regel (RGT-Regel; RGT steht für Reaktionsgeschwindigkeit und Temperatur) besagt, dass sich die Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 °C etwa verdoppelt. Da die Konzentrationen von A und B nicht von der Temperatur betroffen sein können, muss die Konstante k eine Funktion der Temperatur sein!
Svante Arrhenius stellte fest, dass diese Funktion ebenfalls eine Exponentialfunktion ist:
k = A · e-(EA/RT)
In dieser Arrhenius-Gleichung ist EA die bekannte Aktivierungsenergie (kJ/mol). R ist die Gaskonstante (kJ/mol · Kelvin). T ist die Temperatur in Kelvin.
Nimmt man Kinetiken einer Reaktion bei verschiedenen Temperaturen auf, so kann man aus der Temperaturabhängigkeit leicht die Aktivierungsenergie berechnen. Ein wirklich geniales Verfahren!
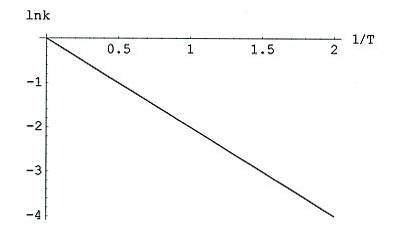
Das kann man auch graphisch machen. Hierzu logarithmiert man zunächst die Arrhenius-Gleichung:
ln k = ln A - EA /R · T
Dann trägt man ln k gegen 1/T auf. Aus der Steigung kann man EA berechnen.

Graphische Bestimmung der Aktivierungsenergie
Der Faktor A in der Arrhenius-Gleichung ist eine empirische Konstante, in die
verschiedene Wahrscheinlichkeitsparameter, Schwingungskonstanten von Molekülen
usw. eingehen. Auf keinen Fall ist A aber, was man ab und zu liest, nämlich der für eine
Reaktion zu erwartende maximale Wert der Geschwindigkeitskonstanten.
Die Bedeutung von A wird deutlich, wenn EA gleich Null wird. Dann sind die
Reaktionen nur noch bestimmt durch die Teilchenbewegung, also durch die Diffusion.
Wir sprechen von diffusionskontrollierten Reaktionen. k wird dann gleich
A!
Den Wert von A ermittelt aus dem obigen Bild: ln A ist der Ordinatenwert bei
1/T = 0.
Wie bei allen Exponentialgesetzen bereitet es immer wieder Schwierigkeiten, abzuschätzen, wie sich die Reaktionsgeschwindigkeit mit der Aktivierungsenergie EA ändert. Beispielsweise halbieren wir den Wert von EA, etwa durch Zusatz einer katalytisch wirkenden Substanz, die bekanntlich EA absenkt. Dazu setzen wir in der Arrhenius-Gleichung formal einmal EA /R · T gleich 1, dann 1/2 und berechnen den jeweils zugehörigen Wert von k:
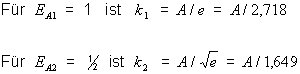
Wenn sich die Aktivierungsenergien verhalten wie
so verhalten sich die Geschwindigkeitskonstanten wie
Die Werte der Geschwindigkeitskonstanten verhalten sich also völlig anders als die zugehörigen Aktivierungsenergien.
Jedoch gilt allgemein: Wird EA bei konstanter Temperatur kleiner, nimmt der Wert von k zu.
Hier ist der formale Grund für die Effektivität der Katalyse zu erkennen.
Weitere Texte zum Thema „Reaktionskinetik“