Prof. Blumes Tipp des Monats Februar 2000 (Tipp-Nr. 32)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Grüner Schimmel im chemischen Labor?
In den Ecken vieler Schullabors sammelt sich so allerlei an. So fand eine Lehrerin in einem herumstehenden Becherglas Reste von Kupfermetall in gelblicher Rostsuspension. Auf der Mischung schwamm grüner Schimmel. Das war Anlass genug für eine Anfrage an das DC2-Team. Wir haben das "Experiment" nachvollzogen.
|
Versuch 1: Wie Eisen(III)-chlorid auf Kupfer wirkt
|
Offenbar zersetzt sich das Kupferblech. Es überzieht sich mit einem weißen Pulver, und auf der Lösung schwimmen blaue, schimmelartige flache Inseln, die an einer transparenten Folie zu hängen scheinen.

Bild 1 (Foto: Daggi)
|
Versuch 2: Untersuchung der Reaktionsprodukte
Dann hebst du mit einem Löffel vorsichtig die auf der Lösung schwimmende
"Schimmelschicht" ab und spülst sie in ein Becherglas.
Tropfe zur ursprünglichen Reaktionslösung etwas Lösung von rotem
Blutlaugensalz (Kalium-Hexacyanoferrat(III)) (Xn) zu.
Zur Untersuchung des grünen "Schimmels" gibst du etwas von der Substanz in ein
Reagenzglas und versetzt sie mit etwas Wasser. Tropfe dann Ammoniak (C) im
Überschuss zu und filtriere.
|
 |
|
Bild 2: Links das mit weißem Kupfer(I)-chlorid überzogene Blech,
rechts der abfiltrierte und gereinigte, dabei gelb gewordene Überzug (Foto: Daggi) |
Was ist passiert?
Kupfer wird offensichtlich durch Eisen(III)-Ionen oxidiert.
Cu + Fe3+ ———> Cu+ + Fe2+
Das Kupferblech überzieht sich dabei mit weißem Kupfer(I)-chlorid, das bekanntlich schwerlöslich und in schwach sauren, chloridhaltigen Lösungen stabil ist. Dieses liegt auch auf dem Gefäßboden um das Blech herum. Die Eisen(II)-Ionen stabilisieren sich als [FeCl4]2--Komplexe.
Das weiße Kupfer(I)-chlorid kann übrigens mit Hydroxid-Ionen zu gelbem Kupfer(I)-hydroxid reagieren, das du von der Fehlingprobe her kennst.
CuCl + OH- ———> CuOH + Cl-
Diese Reaktion läuft schon beim Kontakt mit neutralem und chloridfreien Wasser ab, wie der Versuch 2 zeigt.
An der Luft wird gelöstes Kupfer(I)-chlorid durch Sauerstoff zu blaugrünen Kupfer(II)-Verbindungen oxidiert:
Oxidation: CuCl + Cl- ———> CuCl2 + e-
Reduktion: O2 + 2 H2O + 4 e- ———> 4 OH-
Redox: 4 CuCl + 4 Cl- + O2 + 2 H2O ———> 4 CuCl2 + 4 OH-
Daher rührt der blaugrüne "Schimmel".
Die den "Schimmel" tragende Folie besteht aus Eisen(III)-oxidhydroxid FeOOH. Diese Verbindung bildet sich durch Reaktion von Luftsauerstoff mit Eisen(III)-aquo-Komplexen.
Ist die Oxidation überhaupt möglich?
Ein Vergleich der Eo-Werte (in saurer Lösung) bestätigt dies:
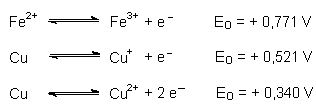
Werden diese Werte nicht durch die Auswirkung der Freien Energie von Folgereaktionen verschoben? Das betrifft die Bildung von schwerlöslichem CuCl-Niederschlag (potentialsteigernd für das Kupfersystem) und die Bildung von Tetrachloroferrat(II)-Komplex-Ionen (potentialsteigernd für das Eisensystem)! Denn gemäß der Gleichung
G = - n · F · EMK
leistet die Freie Energie einen Beitrag zum Redoxpotential. Da sich die Potentiale der beiden Systeme aber in der gleichen Richtung ändern, heben sich diese Effekte weitgehend auf.
Kann man den Effekt nutzbringend anwenden?
In der Elektrotechnik ätzt man mit Eisen(III)-chlorid Leitungsbahnen heraus. Dazu
deckt man auf einer mit Kupfer dünn beschichteten Kunststoffplatte diejenigen Stellen,
die erhalten bleiben sollen, mit Lack ab. (Das geschieht z. B. durch
Fotopolymerisation.) Den Rest ätzt man weg.
Auch Kupferstecher arbeiten statt mit agressiver Salpetersäure lieber mit langsamer
wirkenden Eisen(III)-chloridlösungen. Dadurch entfallen auch die giftigen Stickoxide.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek