Prof. Blumes Tipp des Monats April 2000 (Tipp-Nr. 34)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Was steckt hinter dem Born-Haberschen Kreisprozess?
Das Thema Ionenkristalle steht an. Schwierig wird es, wenn es um die Energieumwandlungen bei der Bildung eines Salzes oder Metalloxids aus seinen Elementen geht. Mit diesen befasst sich der Born-Habersche Kreisprozess. Viele Schüler und Studenten haben Schwierigkeiten damit. Wir wollen versuchen, den Kreisprozess so zu erklären, dass ihn all diejenigen, die guten Willens sind, auch verstehen.

Bild 1: Verbrennen von Natrium in Chlorgas (Quelle: Cornelsen)
Natrium und Chlor reagieren zu Kochsalz
Erhitzt man Natriummetall in einer Chloratmosphäre, so bildet sich in einer heftigen
Redoxreaktion unter Entwicklung von Wärme und Emission von prächtig gelbem Licht
Kochsalz.
Na + ½ Cl2 ———> NaCl /exotherm
(Mit Kalium darf man das auf keinen Fall versuchen. Hierbei gibt es eine heftige Explosion!)
|
Versuch: Verbrennen von Natrium in Chlor
Ergebnis:
|
Die dabei freigesetzte Energie, die Bildungsenergie DHBild
des Salzes aus seinen Elementen, können wir als Wärme kalorisch oder umgekehrt durch
den Verbrauch von elektrischer Energie bei seiner Schmelzelektrolyse ermitteln. (Da die Energien
bei konstantem Druck ausgetauscht werden, spricht man besser von Enthalpien, hier also
von Bildungsenthalpie.)
Was wir aber nicht messen können, ist der Betrag der Energie, die frei wird, wenn sich
aus den freien, unbeeinflussten Ionen das Kristallgitter aufbaut. Diese Energie nennen wir
Gitterenthalpie DHGitt.
Na+ (g) + Cl- (g) ———> NaCl (f) /exotherm
Den Wert der Gitterenthalpie zu kennen ist wichtig für das Verständnis des Aufbaus von Ionenkristallen. Deshalb wurde lange überlegt, ob man den Wert nicht berechnen kann.
Warum ein Kreisprozess?
Der Physiker Max Born und der Chemiker Fritz Haber befassten sich mit
diesem Problem. Zu ihrer Zeit war es in der Thermodynamik üblich, alle Vorgänge in
Kreisprozesse zu überführen. In deren Verlauf wird ausgehend von einem bestimmten
Zustand über verschiedene, energetisch genauso wohl definierte Zwischenzustände der
Ausgangszustand wieder erreicht. Da die Summe aller Energien ("Zustandsgrößen") im
Kreisprozess gleich Null sein muss, lässt sich die eine oder andere
Größe berechnen. (Durch Berechnung solcher Kreisprozesse wurde z. B. von
Max Planck auch das Wirkungsquantum h "entdeckt".)
Zur Untersuchung der Abläufe bei der Bildung von Salzkristallen aus ihren Elementen
zerlegten die beiden Wissenschaftler diesen Prozess, der vor unseren Augen scheinbar in
einem Schritt abläuft, in eine Reihe von Schritten, denen sie jeweils bestimmte Energien
zuordnen konnten und die zusammen einen Kreisprozess ergaben. Born und
Haber konnten so die Gitterenthalpie DHGitt
berechnen. Da jeder Energiewert praktisch ermittelt werden kann, handelt es sich beim
Born-Haberschen Kreisprozess nicht um eine Gedankenspielerei, sondern um einen experimentellen
Zugang zu den Gitterenthalpien!
Als Beispiel wählen wir Natriumchlorid
Wir beginnen mit dem Zustand, in dem die Elemente Natrium und Chlor in ihrem Standardzustand
bei 25 °C und 1,013 bar nebeneinander vorliegen. Wie gesagt, ist es beim Herleiten des
Kreisprozesses unser Bestreben, diesen Zustand wieder zu erreichen.
Die beteiligten Elemente Natrium und Chlor müssen als einatomige Gase vorliegen, bevor
sie miteinander reagieren können. Außerdem müssen beide in Ionen überführt werden. Die Schritte
1,2
und 3,4 laufen deshalb
parallel. Dabei beinhalten die Schritte 1 und 3
die Energien, die man landläufig unter dem Begriff Aktivierungsenergie
zusammenfasst.
1 Der erste Schritt ist die Sublimation von festem Natrium. Dazu müssen wir die leicht messbare Sublimationsenthalpie DHSubl aufwenden. (Diese ist die Summe aus Schmelz- und Verdampfungsenthalpie.)
Na (f) ———> Na (g) DHSubl = + 108 kJ/mol
2 Als nächstes folgt die Ionisierung der Natriumatome. Die zuzuführende Energie ist die Ionisierungsenthalpie DHIon. Die können wir aus spektroskopischen Daten ermitteln.
Na (g) ———> Na+ (g) + e- DHIon = + 502 kJ/mol
3 Chlormoleküle müssen zunächst zu Chloratomen dissoziieren. Die aufzuwendende Energie ist die Dissoziationsenergie DHDiss. Auch dieser Wert kann spektroskopisch ermittelt werden.
½ Cl2 (g) ———> Cl (g) DHDiss = + 121 kJ/mol
4 Die Chloratome nehmen Elektronen auf. Dieser Vorgang ist für Halogene exotherm. Dahinter steckt die Tendenz zur Auffüllung der Chlorschale zum Elektronenoktett der Chloridschale. Diese ebenfalls spektroskopisch sowie durch komplizierte Berechnungen bestimmbare Energie heißt merkwürdigerweise Elektronenaffinität DHElek.
Cl (g) + e- ———> Cl- (g) DHElek = - 354 kJ/mol
5 Die entstandenen Ionen vereinigen sich zu einem Festkörper, dem Salz. Die zugehörige Energie ist die Gitterenergie DHGitt, die wir nicht messen können und deshalb berechnen müssen.
Cl- (g) + Na+ (g) ———> NaCl (f) DHGitt = ? kJ/mol
6 Nun schließen wir den Kreisprozess, indem wir zum Erreichen des Anfangszustands Natriumchlorid z. B. durch Schmelzelektrolyse wieder in seine Elemente zerlegen. Achtung: Die Bildungsenthalpie von NaCl muss diesmal zugeführt werden, bekommt also ein positives Vorzeichen!
NaCl (f) ———> Na (f) + Cl (g) - DHBild = + 411 kJ/mol
Im folgenden Schema wird der Born-Habersche Kreisprozess in seiner ganzen Schönheit gezeigt:
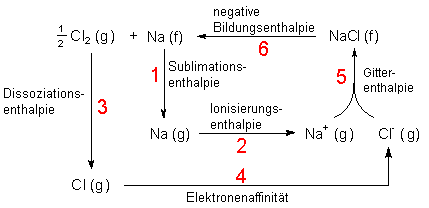
Bild 2: Born-Haberscher Kreisprozess
Nun können wir endlich die Gitterenthalpie berechnen
Es gilt für alle thermodynamischen Kreisprozesse: Die Summe aller Enthalpien ist gleich
Null.
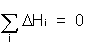
Für den Born-Haberschen Kreisprozess heißt das:
DHGitt + DHSubl + DHIon + DHDiss + DHElek + (- DHBild ) = 0
Zur Berechnung der Gitterenthalpie stellen wir die Gleichung um:
DHGitt = - DHSubl - DHIon - DHDiss - DHElek - (- DHBild )
Nun setzen wir die bekannten Energiewerte (kJ/mol) ein.
DHGitt = - 108 - 502 - 121 + 354 - 411
DHGitt = - 788 kJ/mol
Dies ist die Gitterenthalpie, die freigesetzt wird, wenn jeweils ein Mol Natrium-Ionen mit Chlorid-Ionen das Ionengitter von einem Mol Natriumchlorid bilden.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek