Prof. Blumes Tipp des Monats Mai 1998 (Tipp-Nr. 11)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Eine Batterie ohne Schwermetalle: Das Natrium-Schwefel-Element
Die üblichen Batterien bzw. Akkumulatoren enthalten Schwermetalle und haben deshalb oftmals eine zu große Masse, was ihre Energiedichte (kWh/kg) reduziert. Auch bereitet ihre Entsorgung aufgrund des Elektrodenmaterials Probleme. Ihre Elektrolyte sind ätzende Flüssigkeiten wie Schwefelsäure oder Kalilauge, die zudem mit Schwermetallverbindungen belastet sind.
Eine Alternative ist die Natrium-Schwefel-Batterie (kurz Na/S-Batterie). Sie enthält keine Elektrolytfüssigkeiten und auch keine Schwermetalle. Sie ist viel leichter als die bisherigen Typen. Deshalb wird sie auch schon zumindestens probeweise zum Antrieb von sog. Null-Emissions-Autos (Elektroautos wie z. B. BMW) eingesetzt. Außerdem ist sie wieder aufladbar. Ihre Funktion beruht auf der (unter bestimmten Bedingungen reversiblen) Redoxreaktion zwischen Natrium und Schwefel:
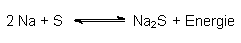
Achtung: Die direkte Reaktion zur Demonstration der Energiefreisetzung darfst du wegen der hohen Explosionsgefahr auf keinen Fall ausprobieren! Du darfst die Substanzen nicht einmal mischen, da sie bei Kontakt sofort unkontrolliert miteinander reagieren können.
Lässt man Reduktion und Oxidation in durch ein Diaphragma getrennten Reaktionsräumen ablaufen, so baut sich eine Spannung auf. Diese beträgt 2,1 V. Verbindet man die Reaktionsräume über einen äußeren Leiter, so fließt ein elektrischer Strom.
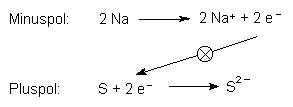
Diese Reaktionsgleichungen sind stark vereinfachte Darstellungen des recht komplizierten Ablaufs im Element. (Zum genauen Reaktionsmechanismus siehe [1].)
Probleme bei der technischen Realisierung:
Schwefel ist ein Isolator:
Schwefel wird durch Zusatz von Graphitpulver elektrisch leitend gemacht.
Die Reaktionsräume sind stofflich strikt voneinander abzutrennen.
Gleichzeitig ist die elektrische Leitfähigkeit zu gewährleisten:
Das geschieht durch eine keramische Membran aus Aluminiumoxid, die aufgrund ihres ionischen Aufbaus
zugleich Elektrolyt und für Natrium-Ionen durchlässig ist.
Die Keramikmembran wird erst ab höherer Temperatur für Ionen
durchlässig:
Der Akkumulator muss auf ca. 290-350 °C vorgeheizt werden.
Natrium reagiert leicht mit Sauerstoff und Wasser:
Die Batterie muss (vor allem, wenn sie erhitzt wird) luftdicht abgeschlossen werden
(siehe Bild 1).
Spannung und Stromstärke sind für den Betrieb eines Autos zu gering:
Viele Einzel-Batterien werden zur Steigerung der Spannung in Reihe und zur Steigerung
der Stromstärke parallel geschaltet (siehe Bild 1).
Heute ist die Na/S-Batterie über ihr Versuchsstadium hinausgekommen. Ihre praktische Energiedichte beträgt 0,120 Kilowattstunden/kg. Sie gilt als das momentan aussichtsreichste System [2].
Überlegungen zum Bau und Betrieb eines einfachen Funktionsmodells der Na/S-Batterie
| 1. | In der Veröffentlichung [1] wurde zur Na/S-Batterie ein Funktionsmodell vorgestellt. Dieses Modell hat allerdings den Nachteil, dass es recht kompliziert ist. Man kann es aber stark vereinfachen [3]. Dann kommt man mit geringen Mitteln aus. Schüler können es im Unterricht sogar selbst rasch herstellen (siehe Bild 2). |
| 2. | Anstelle der Keramikmembran verwenden wir ein Reagenzglas
aus hochwertigem Glas (kein ionenfreies Quarzglas!) zur elektrisch leitenden Trennung der
Reaktionsräume.
Allerdings lässt sich dann die Reversibilität des galvanischen Elements, die im technisch ausgefeilten Prozess möglich ist, wegen des hohen Innenwiderstandes und des damit verbundenen geringen Stoffumsatzes nicht sinnvoll demonstrieren. |
| 3. | Der Nachweis, dass
Energie abgegeben wird, ist außer durch Messen der Spannung mit
einem hochohmigen Voltmeter problematisch: Wegen des hohen Innenwiderstands des Modells
ist die maximal mögliche Stromstärke so gering, dass auch kein noch so
niedrigohmiger Elektromotor betrieben werden kann.
Vielleicht kann euch aber ein Elektrobastler eine Leuchtdiodenschaltung bauen. Bekanntlich ist die Aufnahme an elektrischer Energie durch eine Leuchtdiode äußerst gering. Damit ist der Nachweis des Stromflusses, der im Mikroamperebereich liegt, möglich. |
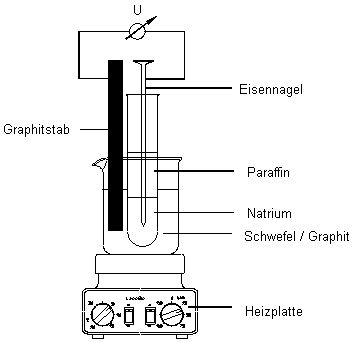
Aufbau des Funktionsmodells einer Na/S-Batterie
|
Versuch: Bau und Betrieb einer Na/S-Batterie
Schülerversuch; mit Aufbau 30 min, Betrieb 10 min. Geräte
Chemikalien
Durchführung
a) Zusammenbau des Elements
Pluspol:
b) Betrieb des galvanischen Elements
Ergebnis
Entsorgung
|
Rüdiger Blume
Literatur
| [1] | G. Dahlke, Die Natrium-Schwefel-Batterie. Praxis (Chemie) 3/38, (1989), 14-18. |
| [2] | VEBA AG (Herausgeber): Das Elektroauto - Fakten und Argumente, Düsseldorf 1992. (Adresse: VEBA AG, Bennigsenplatz 1, 40474 Düsseldorf.) |
| [3] | R. Blume, A. Hildebrand und U. Hilgers: Umweltchemie im Unterricht. Ein praktischer Leitfaden; Cornelsen-Verlag, Berlin 1996, 279 S; (ISBN 3-464-03513-1). |
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek