Prof. Blumes Tipp des Monats Oktober 2015 (Tipp-Nr. 220)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Altlasten sind gefährlich: DNOC
In den Medien hört, sieht und liest man momentan Berichte über einen spektakulären Chemikalienfund in Bonn: Einige Kanister, randvoll mit einem Pflanzenschutzmittel, sorgen für Aufregung. Denn Feuerwehr und Fachleute warnen davor, dass sich das Problem mit einem lauten Knall lösen könnte. Der Stoff ist so brisant, dass selbst Spezialisten für Sprengstoffentsorgung zunächst ratlos schienen.
Unübersehbar ist auf Farbfotos von der Fundstelle, dass eine sattgelbe Substanz aus rostenden Eimern austritt. Wer denkt da nicht an Pikrinsäure und vor allem an deren Salze, die Pikrate?

Bild 1: Feuchte Pikrinsäure
(Foto: Daggi)
Bei der Chemikalie im Bonner Haus handelt es sich jedoch nicht um Pikrinsäure, sondern um 2-Methyl-4,6-dinitro-phenol.
Man kann die Substanz auch als 4,6-Dinitro-o-kresol bezeichnen. Von Letzterem leitet sich die Handelsbezeichnung der Substanz her:
DNOC. (Kresole sind Methyl-Phenole. Es gibt davon drei Isomere. Das -o- steht für ortho und bezeichnet die direkte
Nachbarschaft zwischen der phenolischen Hydroxylgruppe und der Methylgruppe.)
| (1) | 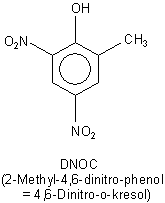 |
Ein Vergleich mit der Pikrinsäure liegt nahe, denn auch sie gehört zu den Nitrophenolen.
| (2) | 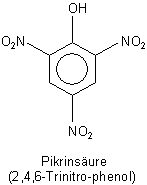 |
Die Pikrinsäure ist eine bekannte Altlast, die in vielen Schul- oder Universitätslabors vor sich hinschlummerte und vielleicht hier und dort auch
noch schlummert. Sie ist als Färbesubstanz für Proteine in der Biologie bekannt. Auch Wolle und Leder lassen sich damit anfärben. Pikrinsäure ist
giftig, lädt aber wegen ihres bitteren Geschmacks (griech. pikros, bitter) kaum zum Naschen ein.
Da die Säure so gefährlich ist, wird sie im Handel nur feucht angeboten und muss auch entsprechend gelagert werden. Sie darf auf keinen Fall eintrocknen, denn dann ist sie - wie auch das DNOC - stoßempfindlich und kann bei Berührung explodieren. Sie wurde sogar als Sprengstoff zur Füllung von Granaten eingesetzt. Das muss man wissen, wenn man in der Sammlung ein entsprechendes Gebinde findet.
Ihre Salze sind noch empfindlicher und dienen deshalb u. a. als Initialzünder. Das ist das Problem bei dem aktuellen DNOC-Fund: Es handelt sich hier in erster Linie um dessen Salze.
Wie kann es überhaupt zur Bildung von DNOC-Salzen kommen?
Wie jedes Phenol reagiert auch diese Substanz sauer. Die Nitrogruppen wirken sogar noch verstärkend auf
die Säureeigenschaft, da sie als -I-Gruppen Elektronen aus dem System abziehen. Dadurch wird quasi der -I-Effekt des Hydroxyl-Sauerstoffs umgekehrt.
Die Bindung zwischen dem O-Atom und dem Wasserstoffatom wird so gelockert; letzteres kann leichter abdissoziieren.
| (3) | 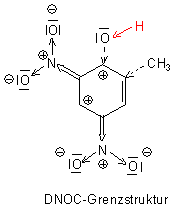 |
Nitrophenole sind deshalb erstaunlich stark sauer wirkend: Der pKa-Wert von Phenol liegt bei 9,89, der von Pikrinsäure bei 1,02.
Der pKa-Wert von Dinitro-kresol liegt wie der von anderen Dinitro-phenolen bei 4.
Da die Substanz in feuchtem Zustand in Eisenkanistern gelagert wurde, ist es zur Korrosion gekommen, wobei sich ausgerechnet die besonders stoßempfindlichen Schwermetallsalze des DNOC gebildet haben. Mit der Zeit trocknete die Masse ein. Wie schon gesagt, sind trockne Salze der Nitrophenole hochexplosiv und extrem stoßempfindlich. Man vergleicht deshalb die Sprengkraft des aktuellen DNOC-Fundes sogar mit der von TNT (Trinitro-toluol).
| (4) | 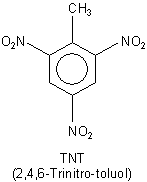 |
Wofür wurde DNOC genutzt?
DNOC ist ein Insektizid. Es wird seit 1892 als Pflanzenschutzmittel eingesetzt. Es sei daran erinnert, dass auch andere Nitrophenolderivate
entsprechend genutzt wurden. Ein Beispiel ist Parathion, bekannter unter seiner Laborbezeichnung E 605.
| (5) | 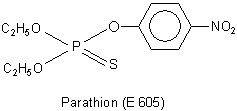 |
Mittlerweile ist der Einsatz entsprechender Präparate verboten.
Wie muss man bei der Entsorgung vorgehen?
Erst einmal sollte man die Substanz vorsichtig anfeuchten. Das wird in Bonn mit Besprühung versucht.
Als Lehre aus dem Desaster mit dem DNOC sei hier noch einmal deutlich darauf hingewiesen, dass chemische Altlasten nicht nur lästig, sondern auch äußerst brisant sein können. Das gilt weiterhin auch für die vielen scheinbar harmlosen Substanzen, die bei längerem Stehen Peroxide bilden können. Ein Beispiel haben wir im Tipp Nr. 195 beschrieben: β-Carotin.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 24. September 2015, Dagmar Wiechoczek