Prof. Blumes Tipp des Monats Dezember 2000 (Tipp-Nr. 42)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
 |
| Bild 1: Weihnachten im Labor (Foto: Daggi) |
Warum glänzen Christbaumkugeln überhaupt?
Weihnachten steht vor der Tür. Überall sieht man die Weihnachtskugeln. Sie sind nicht nur hübsch. Dahinter steckt viel Chemie. Denn gute Weihnachtskugeln werden wie Spiegel versilbert. Das ist für Lehrer und Schüler ein uralter Hut. Aber wir sagen nicht nur, wie es geht, sondern auch, was dahinter steckt und wie man das Ganze vielleicht in den normalen Chemieunterricht zum allgemeinen Erkenntnisgewinn einbringen kann. Deshalb haben wir zum Einstieg auch kein Weihnachtsbild gemacht, sondern das Konvexbild eines unserer Praktikumlabors in einer Weihnachtskugel.
Woraus der Spiegel besteht
Zeigen wir zunächst, dass der Kugelspiegel tatsächlich aus Silber besteht. Sucht dazu Kugeln aus,
die wirklich silbrig warm glänzen und die nicht mit kalt wirkender Alubronze ausgemalt sind!
|
Versuch 1: Analyse des Innenbelags von Weihnachtskugeln
Ag + HNO3 + H+ ———> Ag+ + H2O + NO2 Zum Nachweis von Silber-Ionen tropfst du etwas verdünnte Salzsäure (Xi) auf die Lösung. Es fällt weißes Silberchlorid aus. |
 |
 |
| Bild 2a und b: Silberkugel vor und nach der Behandlung
mit Salpetersäure (Fotos: Daggi) |
Das Versilbern machen auch heute noch viele Glasbläser bzw. deren Angehörigen. Das erkennt
man daran, dass vor Weihnachten in Regionen wie dem Bayerischen Wald, wo Glas hergestellt
wird, viele Leute mit schwarzen Händen herumlaufen. Denn Silber stellt man her, indem man
lösliche Silbersalze reduziert. Und wenn man die Silbersalze an die Hand bekommt, verfärbt sich
diese. Deshalb sollten wir bei unseren Experimenten unbedingt Gummihandschuhe überziehen!
Einige Modellversuche mit Kupferblechen
Zur Verdeutlichung der Vorgänge und Probleme bei der Reduktion von Silber-Ionen setzen wir
zunächst ein unedleres Metall wie z. B. Kupfer als Reduktionsmittel ein.
Die blanken Kupferbleche müssen absolut sauber und mit Alkohol gut entfettet sein. Wir
verwenden deshalb eine Pinzette, um die Berührung mit den Fingern zu vermeiden!
Sicherheitshinweise zur Silbernitratlösung:
Diese lichtempfindliche Lösung bewahren wir in
braunen Glasflaschen auf, die wir zusätzlich kräftig mit Alu-Folie einwickeln. Bei
ammoniakalischen Silbernitratlösungen ist besondere Vorsicht geboten, weil sich bei längerem
Stehen der Lösung feine, schwarze Flocken von hoch explosivem Silbernitrid
(Ag3N) bilden
können. Deshalb musst du die Lösung immer frisch zubereiten und unbedingt reduzieren, bevor du sie
in den Abfallbehälter gibst.
|
Versuch 2: Reduktion von Silber-Ionen mit Kupfer
|
Wir sehen, dass sich Silber nur grobkristallin abscheidet. Man erhält eher einen Metallschwamm
als einen Spiegel.
Wie können wir einen Spiegel herstellen? Dazu müssen wir eine mikrokristalline und stark
haftende Abscheidung erreichen. Das ist durch Zusatz von organischen Substanzen wie
Citronensäure möglich. So stellt man z. B.
die bekannten glänzenden Chromschichten her.
|
Versuch 3: Reduktion von Silber-Ionen mit Kupfer in Gegenwart von Citronensäure
|
Es bildet sich rasch ein schwarzer Überzug. Schwarzes Silber ist bekanntlich mikrokristallin. Es ist allerdings noch nicht allzu fest haftend und glänzt leider auch noch nicht.
 |
| Bild 3: Ergebnisse der Versuche 2, 3 und 4 (von links)
(Foto: Blume) |
Nun wandeln wir den Versuch noch einmal ab. Wir geben jeweils etwas Lösung von Ammoniak
und von tri-Natriumcitrat, dem Salz der Citronensäure, zu.
|
Versuch 4: Reduktion von Silber-Ionen mit Kupfer in Gegenwart von Natriumcitrat
|
Jetzt endlich konnten wir beobachten, wie sich auf dem Kupferblech rasch ein fest haftender silberglänzender Überzug gebildet hat. Unsere Reaktionsmischung liefert bereits schon nach wenigen Minuten ein tolles Ergebnis.
 |
| Bild 4: Das nach Versuch 4 verspiegelte Kupferblech
(Foto: Daggi) |
Die chemischen Vorgänge bei der Kupferverspiegelung
Wenn man genau hinsieht, erkennt man in Bild 3 im oberen Bereich der rechts stehenden Lösung eine blaue
Zone. Das muss erklärt werden.
Die Abscheidung des Silbers auf dem Kupfer ist ein Redoxvorgang. Das Ion eines stärker
elektronegativen Metalls (Ag+) oxidiert das unedlere Metall (Cu).
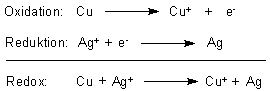
Es entstehen tatsächlich Kupfer(I)-Ionen. Die sind nämlich farblos. Deren Bildung erkennt man auch daran, weil sie nicht mit dem im Überfluss vorhandenen Ammoniak zu tiefblauem Kupfertetraammin-Komplex reagieren. Dieser bildet sich nur mit Kupfer(II)-Ionen, die erst an der Oberfläche der Lösung im Kontakt mit Luftsauerstoff entstehen und sofort zum Komplex weiterreagieren.
2 Cu+ + ½ O2 + H2O ———> 2 Cu2+ + 2 OH-
Cu2+ + 4 NH3 ———> [Cu(NH3)4]2+
Daher rührt die blaue Zone an der Grenze zwischen Luft und Reaktionslösung.
Welche Rolle spielt die organische Substanz?
Sie ist ein Kristallisationsinhibitor. Sie verhindert
den Aufbau großer Kristalle. Dafür gibt es zwei Gründe:
| 1) | Zunächst einmal bindet sie die abzuscheidenden Ionen komplex (Chelate). Damit wird die energetische Hürde zur Kristallbildung hochgeschraubt. |
| 2) | Außerdem lagern sich die Inhibitor-Moleküle an die Wachstumspunkte der wachsenden Kristalle an, stören deren Aufbau. So bilden sich überall neue Keime, die nur langsam weiterwachsen. |
Es gibt auch andere Kristallisationsinhibitoren. Bekannt ist die Glucose. Untersuchen wir einmal, ob man damit das tri-Natriumcitrat in Versuch 4 ersetzen kann.
|
Versuch 5: Glucose als Kristallisationsinhibitor
|
Es bildet sich wieder ein schöner Silberspiegel auf dem Kupferblech. Darüber hinaus jedoch beobachten
wir zusätzlich die langsame Abscheidung von Silber auf der Glaswand.
Glucose ist nämlich nicht nur ein Kristallisationsinhibitor, sondern zugleich ein Reduktionsmittel
für Silber-Ionen. (Darauf beruht zum Beispiel eine Nachweisreaktion für reduzierende Zucker, die
Tollens-Probe.) Vielleicht können wir deshalb das Kupferblech überhaupt weglassen. Es geht tatsächlich.
Zur Beschleunigung der Reaktion erhitzen wir diesmal die Reaktionsmischung. Damit kommen wir auch auf die
zuvor mit Salpetersäure "entspiegelte" Glaskugel zurück.
|
Versuch 6: Verspiegeln von Glas
|
Es bildet sich ein schöner Silberspiegel auf der Wand der Glaskugel. Sie erhält somit ihren Status als Christbaumkugel zurück.
 |
| Bild 5: Die halb verspiegelte Weihnachtskugel von Bild 1
(Foto: Daggi) |
Die chemischen Vorgänge beim Versilbern von Glas
Das Reduktionsmittel wird oxidiert. Dabei wird in die Glucose Sauerstoff eingebaut. Dieser
stammt nicht aus der Luft, sondern aus den Wassermolekülen. Denn das eigentliche
Oxidationsmittel, d. h. die Elektronenakzeptoren, sind die Silber-Ionen!
Die Glucose schreiben wir kurz als Aldehyd.
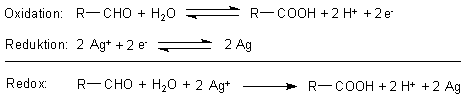
Dass wir hier als Reaktionsprodukt eine Carbonsäure (Gluconsäure) hinschreiben, hat nur formale
Bedeutung. In Wirklichkeit entsteht bei dieser Reaktion aus der Glucose ein Gemisch von schwer
charakterisierbaren, gelbgefärbten Produkten.
Jetzt verstehen wir auch, warum wir in alkalischer Lösung arbeiten: Zur Verschiebung der
Gleichgewichte müssen die Protonen entfernt werden. Wir können auch sagen: Damit
verschieben wir das Redoxpotential der Glucose in den stärker reduzierenden Bereich. Dass es
ohne diese Alkalisierung tatsächlich nicht geht, zeigt der folgende Versuch.
|
Versuch 7: Reduktion von Silber-Ionen in neutraler Lösung
|
Und warum verwendet man dazu das stinkende Ammoniak? Reicht nicht Natronlauge aus? Beim Alkalisieren der Silbernitratlösung bildet sich zunächst festes, braunes Silberhydroxid.
Ag+ + OH- ———> AgOH
Damit könnte man nicht versilbern, denn die Silber-Ionen sollen ja frei an die Glasoberfläche wandern können. Deshalb muss man den Niederschlag wieder auflösen. Dabei bilden sich Silber-Diammin-Komplexe.
Ag+ + 2 NH3 ———> [Ag(NH3)2]+
Diese Komplex-Ionen sind die eigentlichen Oxidationsmittel.
Warum scheidet sich das Silber vorrangig am Glas ab?
Glas wirkt wie ein Ionenaustauscher.
Es adsorbiert auf diese Weise Silber-Ionen. An diesen Stellen setzt die Reduktion ein und bildet
viele Kristallkeime, die den festhaftenden Überzug bilden.
Wie macht man einen flachen Spiegel?
Zunächst werden beide Seiten der Glasplatte versilbert. Dann schützt man eine Seite mit einem schützenden Lack.
Der ist meistens rotbraun gefärbt. Anschließend wird die nicht geschützte Silberschicht entfernt - zum Beispiel
mit einem Silber zersetzenden Bleichmittel wie Rotes Blutlaugensalz
(Kaliumhexacyanoferrat(III)), Kaliumdichromat oder Kaliumpermanganat.
Entsorgung von Silbersalzen
Silbersalze aufzuarbeiten lohnt sich nicht, da der Silberpreis im Keller ist und im Schullabor das
Recycling mehr Umweltschäden anrichtet, als Positives zu bewirken. Jedoch muss man bedenken, dass die
Abfalllösungen Silber-Diammin-Komplexe und Nitrat-Ionen enthalten. Diese bilden beim Stehen extrem gefährliches
Silbernitrid Ag3N. Deshalb müssen diese Lösungen reduziert werden. Am
besten geschieht das mit Einwerfen der Kupferreste oder der Zugabe der restlichen Lösung von
Glucose. Im letzten Fall muss erwärmt werden. Auch Ascorbinsäure ist als
Reduktionsmittel gut geeignet.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 24. Februar 2009, Dagmar Wiechoczek