Prof. Blumes Bildungsserver für Chemie
Tipp des Monats September 2020 (Tipp-Nr. 279)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Ein „life hack“ unter der Lupe: Das Märchen von den fluoreszierenden Schnürsenkeln
Dennis Dietz
Der Abiball steht vor der Tür und im Chemie Leistungskurs herrscht eine lebhafte Diskussion darüber, wie man sich auf einfache Art und Weise ein besonderes Outfit zaubern kann. Marie berichtet von einem sogenannten „life hack“, den sie im Internet gesehen hat [1]. Hierbei können weiße Schnürsenkel mit einfachen Mitteln dazu gebracht werden, bei Dunkelheit zu leuchten. Sie meint: Wir brauchen lediglich Tonic Water, Backpulver und Wasserstoffperoxidlösung. Schnell ist sich der Kurs einig: Alle Chemikerinnen und Chemiker sollten auf der Tanzfläche dieses gemeinsame Erkennungsmerkmal tragen. Bild 1: Unbehandelte Schnürsenkel aus Polyester (links) und Baumwolle (rechts) unter der UV-Lampe
Doch woran liegt das? Weißen Textilien sind in der Regel optische Aufheller – sogenannte Weißmacher – zugesetzt. Dabei handelt es sich um Fluoreszenzfarbstoffe. Die Moleküle dieser Stoffe absorbieren die für uns nicht sichtbare UV-Strahlung und emittieren längerwelliges Licht in einem Wellenlängenbereich von 400 – 480 nm, den wir sehen können. Durch diese Emission von blauem Licht werden im Material vorhandene Gelbtöne überdeckt und das Produkt kann mit dem Slogan „Weißer als Weiß“ beworben werden. Eine wichtige Stoffgruppe für die optische Aufhellung stellen beispielsweise die Stilbene dar [2]. Bild 2: Strukturformel eines Stilbenderivats, das für die optische Aufhellung von Polyesterfasern geeignet ist [2]
Bild 3: Strukturformel von Chinin
Im nächsten Schritt überprüften wir also experimentell, ob sich Stoffe mit Tonic Water Stoffe so färben lassen, dass sie unter UV-Licht fluoreszieren. Für die Färbeversuche verwendeten wir unbehandelte Schafswolle, da diese keine optischen Aufheller enthält. Versuch 1: Herstellung fluoreszierender Schafswolle Die Schafswolle wird in vier gleich große Portionen (A bis D) geteilt. Anschließend werden drei Proben für zehn Minuten in ein Becherglas mit Tonic Water gelegt und anschließend folgendermaßen behandelt: B: Lediglich aus dem Becherglas genommen und abgetropft. C: Aus dem Becherglas genommen und mit einem Föhn getrocknet. D: Aus dem Becherglas genommen, unter fließendem Wasser gewaschen und schließlich mit einem Föhn getrocknet. Die drei Schafswollproben werden schließlich unter der UV-Lampe mit der unbehandelten Probe A verglichen. Bild 4: Ergebnis der Färbeversuche mit Tonic Water
Überraschung: Die weißen Schnürsenkel „leuchten“ sowieso im UV-Licht
Nachdem wir uns das von Marie beschriebene Video gemeinsam angesehen hatten, wollten wir den Versuch reproduzieren. Recht schnell kam dann die Überraschung: Unabhängig davon ob aus Baumwolle oder Polyester – immer „leuchteten“ die Schnürsenkel unter der UV-Lampe.
(Foto: Dietz)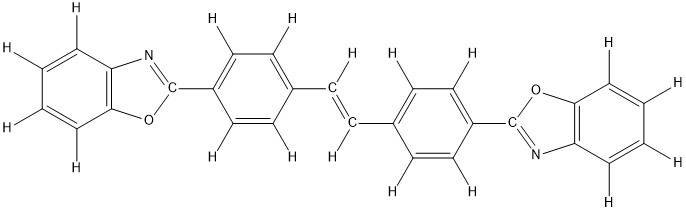
(Foto: Dietz)
Eignet sich Tonic Water prinzipiell als Färbemittel?
Nun stellte sich unserem Chemiekurs die Frage, ob das gesamte Video Unsinn ist oder wir einfach nur die falschen Schnürsenkel erworben hatten. Tonic Water enthält Chinin, das aus der Chinarinde gewonnen werden kann. Chinin verursacht den bitteren Geschmack in Tonic Water und wird bis heute als Medikament verwendet. Einst war es sogar das einzige Heilmittel gegen Malaria [3]. Chinin weist fluoreszierende Eigenschaften auf. Dies kennt man beispielsweise vom Gin Tonic. In einer schumrigen Bar leuchtet der Drink auf wundersame Weise. Viele weitere interessante Informationen und Versuche zum Chinin finden Sie hier.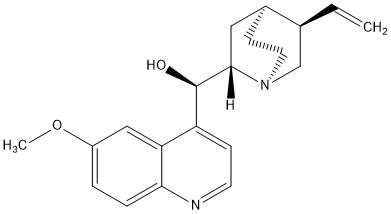
(Foto: Dietz)

(Foto: Dietz)
Auf dem Bild ist gut zu erkennen, dass prinzipiell mit Tonic Water gefärbt werden kann. Allerdings findet die Färbung ungleichmäßig statt und kann durch einen einfachen Waschvorgang schnell beseitigt werden. Das gilt aber auch für viele kommerziell erhältliche Produkte, die mit speziellen Fluoreszenzfarbstoffen gefärbt sind.
Wozu werden in dem Video Backpulver und Wasserstoffperoxid verwendet?
Vielleicht ist das Färbeergebnis ja besser, wenn wir – wie in dem Video auch – Backpulver und Wasserstoffperoxid verwenden? Textilien werden industriell u.a. mit Wasserstoffperoxid gebleicht, um den natürlichen gelben oder grauen Farbeindruck von natürlichen und synthetischen Textilfasern zu entfernen [4]. In einer basischen Lösung beruht die oxidierende Wirkung des Wasserstoffperoxids dabei auf dem Zerfall in Sauerstoff und Wasser [5].
H2O2 → H2O + O
Nun verringert jedoch eine konzentrierte Wasserstoffperoxidlösung die Zugfestigkeit von Wolle signifikant [6]. Wäre es also vorstellbar, dass sich die molekulare Struktur der Wolle bei der Behandlung so verändert, dass das Chinin besser eingelagert werden kann? Das wird im folgenden Versuch untersucht:
|
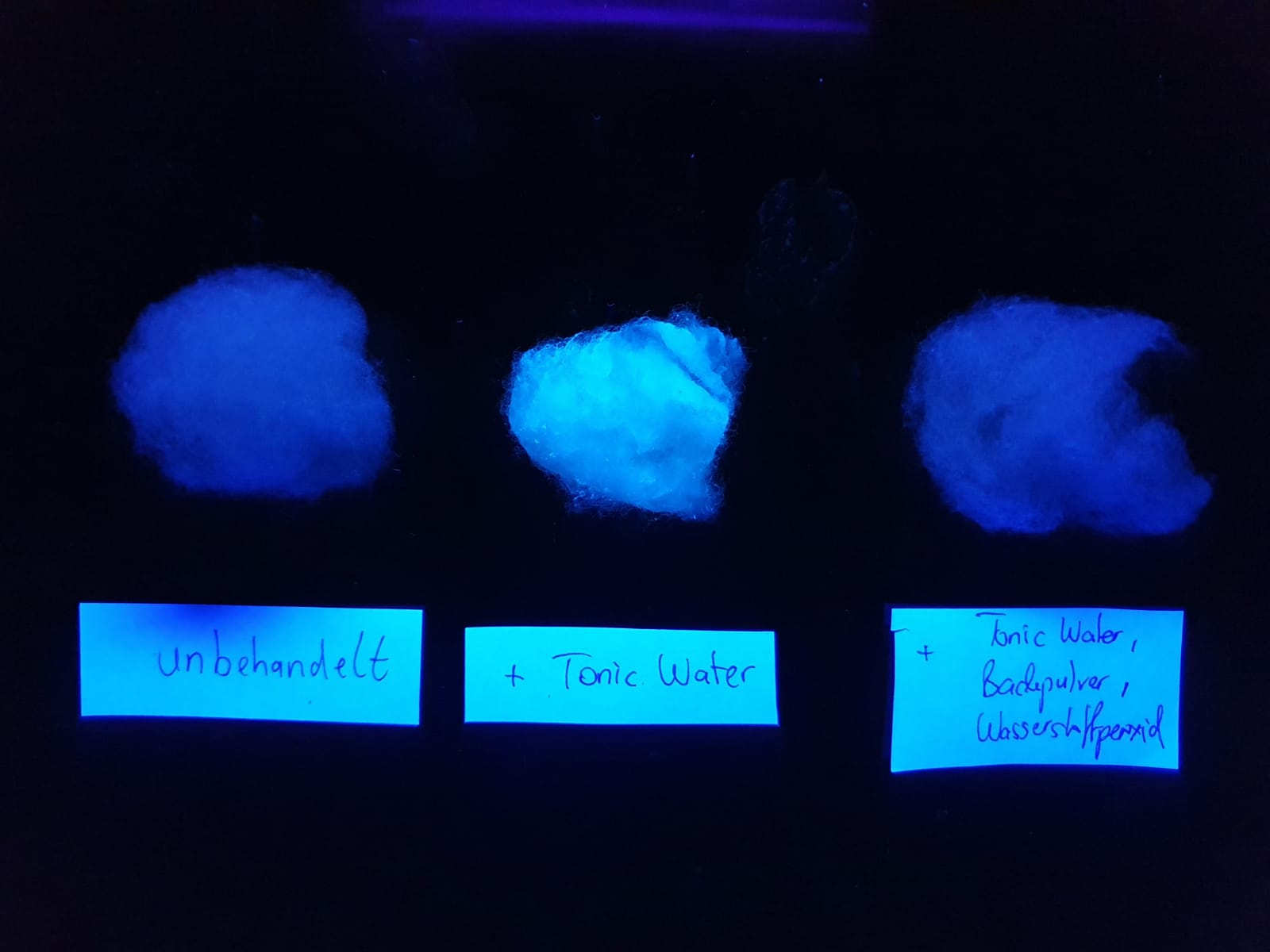
Versuch 2: Untersuchung des Einflusses von Wasserstoffperoxid und Backpulver auf die Herstellung fluoreszierender Schafswolle Zwei Schafswolle-Proben werden für jeweils zehn Minuten in die folgenden Lösungen gelegt: B: 100 mL Tonic Water C: 100 mL Tonic Water + ein Teelöffel Backpulver + 2 mL 30 %-ige Wasserstoffperoxidlösung Anschließend werden die Proben abgetropft und zusammen mit unbehandelter Schafswolle (Probe A) unter der UV-Lampe betrachtet.
Bild 5: Durch die Zugabe von Backpulver und Wasserstoffperoxidlösung ist es nicht möglich, fluoreszierende Schafswolle zu erhalten
|
Unser Ergebnis: Es tritt nicht nur keine Verbesserung ein, sondern die so behandlete Schafswolle fluoresziert nun nicht mehr. Der Einsatz von Wasserstoffperoxid und Backpulver ist also sinnlos!
Zum Abschluss unserer Untersuchungen stellte sich uns nur noch die Frage, ob ein einzelner Inhaltsstoff oder die Kombination mehrerer zu dem Verlust der fluoreszierenden Eigenschaften führen. So ist es denkbar, dass die Fluoreszenz des Chinins pH-abhängig ist und daher durch das Backpulver beeinflusst wird. Genauso denkbar ist eine Reaktion des Oxidationsmittels Wasserstoffperoxid mit dem Chinin, bei der dessen Struktur verändert wird.
|
Versuch 3: Identifikation der Ursache für den Verlust der fluoreszierenden Eigenschaften Es werden die folgenden Lösungen in verschiedene Bechergläser vorgelegt und für zehn Minuten unter einer UV-Lampe betrachtet: A: 100 mL Tonic Water + ein Teelöffel Backpulver
B: 100 mL Tonic Water + 2 mL 30 %-ige Wasserstoffperoxidlösung
C: 100 mL Tonic Water + ein Teelöffel Backpulver + 2 mL 30 %-ige Wasserstoffperoxidlösung
Bilder 6-8: Die Fluoreszenz nimmt nach der Zugabe von Wasserstoffperoxidlösung leicht ab
|
Auf den Bildern ist gut zu erkennen, dass Backpulver keinen Einfluss auf die Fluoreszenz des Chinins hat. Im Gegensatz dazu nimmt die Fluoreszenz durch die Zugabe von Wasserstoffperoxidlösung leicht ab. Dieser Effekt wird in Anwesenheit von Backpulver etwas verstärkt. Es ist also davon auszugehen, dass das Chinin durch Oxidation in ein oder mehrere Reaktionsprodukte überführt wird, die keine fluoreszierenden Eigenschaften mehr besitzen.
Mein Fazit
Nicht nur, dass die Schnürsenkel unter den geeigneten Lichtbedingungen sowieso schon leuchteten, auch der Tipp mit Wasserstoffperoxid und Backpulver zu arbeiten, hat sich als nicht hilfreich herausgestellt. Um es in der Sprache unserer Schülerinnen und Schüler auszudrücken: Dies ist kein „life hack“, sondern ein „fake“. Das Internet liefert ein Sammelsurium von weiteren „life hacks“, in denen chemische Inhalte thematisiert werden. Das Aufgreifen dieser Videos im Unterricht stellt eine geeignete Möglichkeit dafür dar, chemische Inhalte in einen interessanten Kontext einzubetten und gleichzeitig sowohl die experimentellen als auch die Bewertungs- und Medienkompetenzen der Schülerinnen und Schüler zu fördern.
Literatur:
[1] https://m.youtube.com/watch?v=B9m5Uxu-OOQ (zuletzt abgerufen am 20.07.2020)
[2] U. Claussen, Angewandte Fluoreszenz: Weißtöner. Chemie in unserer Zeit. Band 7, Nr. 3, 1973, S. 141–147,
[3] S. Streller, K. Roth, Von der Apotheke an die Bar. Eine Rinde erobert die Welt, Chem. Unserer Zeit, 2012, 46, 228-247.
[4] A. Kalweit, P. Christof, S. Peters, R. Wallbaum, Handbuch für Technisches Produktdesign, Springer-Verlag Berlin Heidelberg, 2006, S. 270.
[5] N. Wiberg, A. F. Hollemann, Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin, New York, 2007, 102. Auflage, S. 537.
[6] S. F. Chou, R. A. Overfelt, W. F. Gale, H. S. Gale, C. G. Shannon, G. Buschle-Diller, J. Watson, Effects of Hydrogen Peroxide on Common Aviation Textiles. Defense Technical Information Center, Ft. Belvoir, VA 22060; and the National Technical Information Service, Springfield, VA 22161, 2009, 1-26.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 30. August 2020, Fritz Meiners