Analyse und Synthese von Wasser
Experimente:
Versuch: Die Wassersynthese: Verbrennen von Wasserstoff
Versuch: Knallgas-Explosion
Versuch: Elektrolyse von Wasser
Wassersynthese
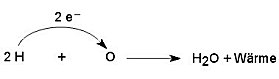
Wasser ist das Oxid des Wasserstoffs. Im einfachsten Fall
bildet es sich bei der Verbrennung von Wasserstoff mit Sauerstoff, also bei der direkten
Reaktion zwischen den Elementen (-> Versuch). Dabei schließen sich jeweils zwei
Wasserstoffatome und ein Sauerstoffatom zu einem Wassermolekül zusammen.
2 H2 + O2 ———> 2 H2O /exotherm
Wasserstoff wird oxidiert, Sauerstoff reduziert. Es handelt sich hierbei um eine Elektronenübertragungsreaktion.

Ungezähmt ist das die bekannte Knallgasreaktion (-> Versuch).
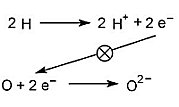
Wasseranalyse
Dass sich zwei Moleküle Wasserstoff und ein Molekül Sauerstoff bei der Wassersynthese zu Wasser
verbinden, kann man auch anhand der Analyse von Wasser zeigen. Das gelingt besonders gut bei der
Elektrolyse, d. h. durch Wasseranalyse mit Hilfe des elektrischen Stroms
(-> Versuch). Hierbei stellen wir fest, dass am Minuspol
zwei Volumenteile Wasserstoff und am Pluspol ein Volumenteil Sauerstoff entstehen. Wenn wir wie
Avogadro einmal annehmen, dass verschiedene Gase in gleichen Volumina die gleiche Anzahl Moleküle
enthalten, bestätigt das Ergebnis der Analyse die Reaktionsgleichung für die Synthese.
2 H2O ———> 2 H2 + O2 /endotherm
Lies hierzu auch: Was läuft bei der Elektrolyse von Schwefelsäure eigentlich ab?
Bei der Wassersynthese muss es nicht immer knallen
Anstelle der Wärme und Volumenarbeit, die bei der Knallgasexplosion anfallen, kann man die
Reaktionsenergie auch in technisch nutzbringende Formen umwandeln. Zur Zähmung der
Knallgasexplosion lässt man die Elemente in getrennten Reaktionsräumen reagieren.
Die Redoxreaktionen laufen an katalytisch wirksamen Oberflächen ab. Der Elektronentransfer
zwischen Wasserstoff und Sauerstoff erfolgt über einen äußeren Leiter, wobei elektrische
Energie abgezapft werden kann. Dadurch wird der Wirkungsgrad der
Reaktion enorm gesteigert. Dies ist das Prinzip der Knallgaszelle, der einfachsten
Brennstoffzelle.
Weitere Bildungsreaktionen für Wasser sind Verbrennungsprozesse von wasserstoffhaltigen Verbindungen wie Glucose.
In atmenden Lebewesen gibt es dazu zur nutzbringenden, schonenden Energieumwandlung spezielle Organellen, die Mitochondrien. In ihnen läuft längs der Atmungskette ein Elektronentransfer ab, in dessen Verlauf Wasserstoff-Ionen und Sauerstoff-Ionen entstehen und zusammen Wasser bilden. Die Reaktionsenergie fällt zum großen Teil als wertvolle chemische Energie in der Form von ATP an.
Lies hierzu auch Die biochemische Endoxidation und Atmungskette sowie die Folie.
Die Wasserzerlegung ist auch mit Lichtenergie möglich
Die Energie zur Elektrolyse von Wasser kann durch Ausnutzung der Sonnenenergie mit Hilfe der
Fotovoltaik gewonnen werden. Der Wirkungsgrad ist mit weit unter 10 % jedoch miserabel.
Raffinierter machen es die Pflanzen und viele Mikroorganismen. Diese schaffen es mit
ihrem Apparat zur Fotosynthese, mit zwei Sonnenlichtquanten ein Wassermolekül
in seine Elemente zu zerlegen. Dabei wandeln sie noch überschüssige Sonnenenergie in chemische
Energie um und speichern sie als ATP.
Weitere Texte zum Thema „Wasser“