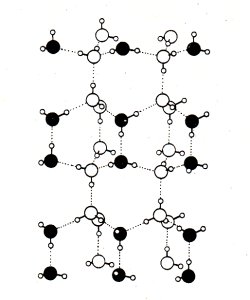
Abb. 1: Anordnung der H2O-Moleküle im Eiskristall.
Die gepunkteten Linien stellen die Wasserstoffbrücken dar
1 Hydrosphäre
Lesen Sie auch unsere Webseite Wasser und Leben !
1.1 Überblick
Ohne Wasser gibt es keine Lebensvorgänge, wie wir sie kennen. (Bei Sauerstoff ist dies anders. Grundreaktionen wie die foto-synthetische Stoffproduktion oder glykolytische Energieumwandlung kommen ohne Anwesenheit von Sauerstoff aus.) Aber auch Bodengestaltung und Luftaustausch sind ohne Wasser in Form von Wasserdampf, Regen, Eis oder Gewässern nicht denkbar.
Größere Mengen von Wasser benötigt die Menschheit direkt für
| - | Trinken und Lebensmittelzubereitung |
| - | Freizeit und Hygiene |
| - | Verkehr |
| - | Produktion |
| - | Energieumwandlung |
| - | Bewässerung in Landwirtschaft |
Zur Verdeutlichung der Wasserproblematik seien einige Zahlen aus dem Jahr 1990 genannt:
In den privaten Haushalten und Kleinbetrieben beträgt der durchschnittliche Frischwasserverbrauch pro Person 150 l/d. (Mitte der Achtziger war es die Hälfte. Im Jahr 2000 sind es wieder 128 l.) Davon werden gebraucht für
| Essen, Trinken, Speisenzubereitung | 2,5 % |
| Toilettenspülung | 32 % |
| Baden, Duschen | 29 % |
| Wäschewaschen | 12 % |
| Garten | 5 % |
| Geschirrspülen | 7,5 % |
Man schätzt, dass allein durch tropfende Wasserhähne ca. 50 Mio. m3/a Wasser verlorengehen.
Dem gegenüber steht die zunehmende Wasserverschmutzung, die eine aufwendige Technologie zur Reinigung erforderlich macht. 11 % der öffentlichen Haushaltsmittel werden in den alten Bundesländern für die Entsorgung von Abwässern ausgegeben. Behandelt werden müssen jährlich 9,2 Milliarden m3 Abwasser. So liegt die Produktion von Putz- und Reinigungsmitteln momentan bei 2,2 Mio. t/a (pro Person 36 kg).
Grundlage für die Vielfalt der Verwendung von Wasser sind seine chemischen bzw. physikalischen Besonderheiten.

Abb. 1: Anordnung der H2O-Moleküle im Eiskristall.
Die gepunkteten Linien stellen die Wasserstoffbrücken dar
1.1.1 Aggregatzustandsänderungen des Wassers
Das gewinkelte Molekül H2O ist ein Dipol.
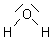
Die Wasserdipole sind untereinander durch Wasserstoffbrückenbindungen verknüpft (-> Abb. 1). Das hat die hohe Siedetemperatur von 100 °C und den großen Flüssigbereich von 0 - 100 °C zur Folge. (Man vergleiche dieses Verhalten mit ähnlichen großen Molekülen wie Schwefelwasserstoff H2S oder Methan CH4. Diese haben sehr niedrige Siedepunkte und sind deshalb bei Raumtemperatur Gase.)
Sprungschicht
Bemerkenswert ist, dass flüssiges Wasser beim Abkühlen bzw.
Erwärmen sein Volumen nicht (wie Hg) linear ändert, sondern
dabei ein Minimum durchläuft. Bei einem jährlichen
Temperaturanstieg (wie momentan) von 0,3 °C steigt der
Wasserspiegel weltweit um 6 cm.
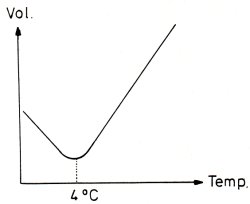
Abb. 2: Volumenveränderung von Wasser mit der Temperatur
Bei 4 °C zeigt Wasser sein Volumenminimum. Wichtig ist, dass die Temperatur zwar die Dichte bestimmt, umgekehrt aber auch die Dichte die Gleichgewichtstemperatur festlegt. Unter hohem Druck, also in tieferem Wasser, bildet sich hier stets die maximale Dichte aus. Damit muss sich automatisch die Gleichgewichtstemperatur von 4 °C einstellen. Eine Unterschreitung dieser Temperatur ist im tieferen Wasser (also unter Druck) nicht möglich. Unterhalb dieser sog. "Sprungschicht" oder Sprunganomalie beginnt die Zone maximaler Dichte und praktisch konstanter Temperatur. Das ist aber auch der Bereich mit minimalem Stoffaustausch.
Deshalb sind auch im Sommer in tieferen Gewässern kaum wärmebedingte Vertikalströmungen zu beobachten (ohne Anomalie sollte es sie geben). Sauerstoff gelangt nur durch Diffusion in diese Schicht, deshalb ist Wasser unter der Sprungschicht besonders vom Umkippen, das heißt von Anaerobie, bedroht. Die Sprungschicht liegt in der Ostsee momentan bei 9 m Wassertiefe, im Schwarzen Meer bei 50 m.
Im Winter frieren tiefere Seen deshalb nicht bis zum Boden zu (ohne die Sprunganomalie würden sie von unten her zufrieren). Hinzu kommt noch, dass Eis auf Wasser schwimmt, da Wasser beim Gefrieren eine 9%ige Volumenzunahme erfährt. Zusätzlich ist im Eis viel Luft eingeschlossen.
Die Volumenzunahme beim Gefrieren ist Ursache für die geophysikalische Wirkung von Wasser. Wasser in Gesteinsporen sprengt beim Kristallisieren Gesteine und sorgt so für ständige Bodenneubildung. Wasser kristallisiert übrigens im gleichen sperrigen Gittertyp wie Quarz (-> Abb. 1). Die trigonale Struktur führt zu drei- bis sechsstrahligen Schneeflocken. (Ersetzt man in Abb. 1 die O-Atome durch Si und die H-Atome durch O, so erhält man das Gitter des Bergkristalls.) Unter Druck verflüssigt sich Eis wieder: Ursache für die Gletscherwanderung, aber auch Grundlage für Wintersport!
1.1.2 Wasser als Lösemittel
Das Lösungsvermögen hängt von der Art (Polarität) des zu lösenden Stoffes sowie von Druck und Temperatur ab.
- Luft
1 l Wasser löst bei 25 °C 10,3 cm3 O2 und 18,1 cm3
N2 (Verhältnis 1:1,8). Zum Vergleich: Die Luft enthält O2:N2
im Verhältnis 1:4. Wasser reichert also Sauerstoff um den Faktor
2 an und ermöglicht auf diese Weise tierisches
Wasserleben.
- CO2, SO2 und NOx
Diese Gase lösen sich - obgleich sehr unpolar - relativ gut, da
sie durch chemische Reaktionen weiterverbraucht werden.
Sie sind Säureanhydride, die mit Wasser Säuren bilden; z. B. Kohlensäure:
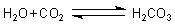
Sie können durch Folgereaktionen (wie Oxidation unter Gipsbildung oder Kalkbildung durch kalkschalenbildende Organismen oder Fotosynthese) aus dem Lösungsgleichgewicht entfernt werden. (Dies ist für den Treibhauseffekt wichtig, da die Ozeane momentan noch instabiler Speicher für physikalisch gelöstes CO2 sind.)
- Ammoniak NH3
Ähnliches gilt für Ammoniak NH3, das ein Baseanhydrid ist. In
einem Liter Wasser lösen sich bei 20 °C etwa 700 l NH3-Gas. Dabei
reagiert ein Teil des gelösten Ammoniaks zu Ammonium-Ionen:
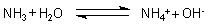
- Chlorwasserstoff HCl
HCl-Gas löst sich bei 20 °C zu 500 l/l Wasser. Es dissoziiert dabei
unter Einwirkung der Wasserdipole vollständig ("quantitativ") in H+- und
Cl--Ionen, ist also eine starke Säure:
HCl + H2O ———> H3O+ + Cl-
- Ionen
Salze und andere Elektrolyte werden besonders gut gelöst
(Ion-Dipol-Wechselwirkung). Dies gilt auch für die so genannten
schwerlöslichen Salze wie Gesteine, Erze, aber auch
Quecksilbersulfid HgS (Mobilisierung). Damit werden
chemische Reaktionen zwischen den Ionen möglich
(Neutralisation, Pufferung, Sedimentbildung,
Bodenerneuerung).
- Weniger polare Lösemittel
Auch so genannte "wasserunlösliche", hydrophobe unpolare Stoffe
lösen sich. Hier spielen unpolare Bindungen eine Rolle. Das Wasser umgibt die
Moleküle wie ein Käfig (Methan-Eis!). So gelangen CKW, FCKW, Benzol und andere
organische Lösemittel in das Wasser.
- Korrosionsmedium
Wasser ist für Korrosionsprozesse unerlässlich.
1.1.3 Natürliche Wasserressourcen
Regenwasser enthält viele gelöste Stoffe. Es ändert seine Zusammensetzung erheblich beim
Oberflächenwasser ist deshalb besonders vom Schadstoffeintrag betroffen. Es wird in seinen Eigenschaften vor allem beeinflusst durch Niederschläge, Abwässer aus Haushalt und Gewerbe, Landwirtschaft, Klärwasser, Kraftwerke, eindringendes Grundwasser, Pflanzenwachstum, tierisches Leben und anaerobe Prozesse.
Die Zusammensetzung von Grund- und Quellwasser hängt von der Belastung der Erdoberfläche und von den durchströmten Mineralienmischungen ab. Eine wichtige Rolle spielen dabei
Bei der Einstellung der Ionenkonzentration können auch schwache Säuren wie die Kohlensäure H2CO3 eine unerwartet zentrale Rolle spielen: In Karstgebieten (Schwäbische Alb, Jugoslawien) löst sich Kalkstein CaCO3 in kaltem und deshalb besonders CO2-haltigem Wasser auf, da das gebildete Calciumhydrogencarbonat leicht löslich ist:
CaCO3 (fest) + H2O + CO2 ———> Ca2+ + 2 HCO3
Die Konzentration von Ionen wird durch die Wasserhärte (angegeben als Deutsche Härtegrade; °dH) charakterisiert:
1 °dH = 1 mg CaO/100 ml Wasser = 0,179 mmol Ca2+
1.1.4 Sauerstoffgehalt natürlicher Gewässer
Natürliche Gewässer sind ein überaus vielfältiger Lebensraum. Zufuhr und Verbrauch von allen möglichen Stoffen, aber auch von Sauerstoff, halten sich in gesundem Wasser die Waage. Die Sauerstoffbilanz ist deshalb ein Maß für die Qualität des Wassers. Fische benötigen unterschiedliche Mengen an O2: Forellen benötigen Vollsättigung (ca. 15 mg/l), Karpfen um 4 mg/l und Aale weniger als 1 mg/l. Je niedriger die Wassertemperatur ist, desto höher ist der O2-Gehalt.
Quellen für die Zufuhr von O2
Gründe für den Verbrauch von O2
Beispiele für die aerobe Mineralisation von organischem Material durch Lebewesen sind:
| Amine | R-NH2 + O2 | ——...——> | R-OH + NO3- |
| Mercaptane | R-SH + O2 | ——...——> | R-OH + SO42- |
| Alkohole | R-OH + O2 | ——...——> | CO2, HCO3- |
Von der Sauerstoffbilanz hängt es ab, ob ein Gewässer umkippt. Ist das Nahrungsangebot höher als der entsprechende O2-Gehalt, geht der See rasch in den sauerstofffreien Zustand über. Jetzt leben anaerobe Bakterien auf. Reduktive Gärungsprozesse treten in den Vordergrund. Grundlage hierfür ist, dass statt O2 auch andere Stoffe als Elektronenakzeptor oder Akzeptor für Reduktionsäquivalente [H] aus der Nahrung (als NADH, FADH etc.) dienen können. Beispiele für solche anaeroben Oxidationsmittel sind:
Sulfat-Ionen:
SO42- + n [H] ——...——> H2S
Nitrat-Ionen:
NO3- + n [H] ——...——> NO2-, N2O, NH3/NH4+
Phosphat-Ionen:
H2PO4- + n [H] ——...——> H3P (selbstentzündliches Phosphin, "Moorleuchten")
Methanol:
CH3OH + n [H] ——...——> CH4 (Methan, Sumpfgas)
1.1.5 Beurteilung der Wassergüte
a. Subjektiver Eindruck
Farbe, Trübung, Geruch, Geschmack.
b. Allgemeine objektive Indikatoren
pH-Wert, elektrische Leitfähigkeit, Temperatur, quantitative
Trübungsmessung.
c. Sauerstoffzahlen
- DO (Dissolved Oxygene, gelöste Menge an Sauerstoff mg/l).
- CSB (COD) (chemischer Sauerstoffbedarf, Chemical Oxygene
Demand).
- BSB (BOD) (biologischer oder biochemischer
Sauerstoffbedarf). Hierunter versteht man die Menge an
Sauerstoff, die von Mikroorganismen zum Abbau organischer
Substanzen im Wasser und unter Lichtausschluss bei 20 °C in bestimmter
Anzahl von Tagen (vermerkt als Index, z. B. BSB5 für 5 Tage)
verbraucht wird.
d. Anionen
In den Klammern ist vermerkt, wofür die Anionen als Indikator dienen.
| Cl- | (Salinität) |
| NO3- | (Überdüngung) |
| NO2- | (Bakterielle Mineralisationsprozesse von relativ frischen biologischen Verunreinigungen) |
| PO43- | (Überdüngung, synthetische Waschmittel, Fäkalien) |
| SO32- | (Schwefeleintrag durch Energieumwandlungstechnologie und Industrie (Metallurgie)) |
| HS- | (Bakterieller anaerober Abbau) |
| SO42- | (Versauerung des Bodens, auch Hinweis auf vergrabenen Bauschutt) |
| CN- | (Galvanikabwässer) |
| HCO3- | (Wasserhärte) |
e. Kationen
| Na+ | (Salinität) |
| K+ | (Salinität, Überdüngung) |
| Ca2+, Mg2+ | (Wasserhärte) |
| NH4+ | (Überdüngung mit Betriebsdünger, bakterieller Abbau von Biomasse, undichte Kanalisation, Ausscheidungen von Fischen und Wasservögeln) |
| Schwermetall-Ionen | (Industrie, Kraftfahrzeuge, undichte Mülldeponien, Weinbau, usw.) |
f. Organisches Material
Der TOC (Total Organic Chemicals) ist ein typischer Summenparameter, mit dem folgende
Stoffe erfasst werden:
Der AOX-Wert umfasst die adsorbierbaren organischen Halogenide (CKW).
g. Bakteriologische Untersuchung
Das Auftreten coliformer Bakterien weist z. B. besonders auf
enge Nachbarschaft der untersuchten Wasserquelle zu
Fäkalien hin.
1.1.6 Bestimmungsverfahren zur Wassergüte
A Bestimmung von O2
DO-Wert
- Titration nach Winkler:
Mn(II)-Ionen werden im basischen Milieu durch O2 zu Mn(III)-Verbindungen oxidiert.
Diese wiederum oxidieren Iodid zu Iod. Iod wird mit Thiosulfat zurücktitriert.
- Polarographie:
O2 wird an einer Hg- oder Platin- und anderen Elektroden in überschüssigem
"Leitelektrolyten" zu H2O2
und weiter zu OH--Ionen reduziert. Der resultierende Diffusionsstrom wird gemessen.
Er ist proportional zur Konzentration von O2.
- Clark-Elektrode (Mackereth-Zelle):
Polarographische Messung bei konstanter Spannung (amperometrisches Verfahren).
O2 tritt durch eine Membran in den
Messraum mit einer Platin- oder Goldelektrode.
CSB/COD
Der chemische Sauerstoffbedarf wird durch Titration mit
Lösungen von Kaliumpermanganat KMnO4 bestimmt. Dabei
werden alle oxidierbaren Stoffe erfasst.
BSB/BOD
Die übliche Bestimmung dauert 2 - 5 Tage (z. B. BSB5). Das
Ergebnis hängt von vielen Parametern ab, die genau definiert
werden müssen.
Das Verdünnungsverfahren zur Bestimmung von BSB wird bei
unbekannter Belastung durchgeführt. Es wird im dunklen Gefäß
und unter guter Belüftung gearbeitet, bis das Wasser völlig
ausgezehrt ist, d. h. von organischem Material befreit ist.
Beim Warburgverfahren misst man volumetrisch den
O2-Verbrauch.
B Stickstoffbestimmung
Bestimmung von NH3
2 [HgI4]2- + NH4+ ———> [Hg2N]+ + 4 HI + 4 I-
Nitratbestimmung
Organisch gebundener Stickstoff
Gesamtstickstoff
C Phosphatbestimmung
Fotometrische Bestimmung mit Molybdatreagenz (Bildung
einer komplexen Heteropolysäure und Reduktion unter
Entwicklung einer blauen Färbung).
Ionensensitive Elektroden
Solche Elektroden erfassen nur bestimmte Ionenarten. Sie gibt
es z. B. für H+-Ionen (Glaselektrode) oder Halogenid-Ionen
(Bromidelektrode).
Enzymelektroden
Diese enthalten in einer Membran fixierte Enzyme, die bei ihrer
spezifischen Reaktion Produkte bilden, die gemessen werden
können. Ein Beispiel ist die Urease als Indikator für Harnstoff.
Der Messraum enthält eine Glaselektrode, da das Enzym bei
der Abbaureaktion Ammoniak bildet und dabei den pH-Wert
der Lösung verändert.
Ionenaustauscher
Diese tauschen z. B. Kationen gegen Protonen aus, so dass man
durch einfache Säure/Base-Titration die Kationenkonzentration
bestimmen kann (-> Versuch). Ionenaustauscher gibt es auch
maßgeschneidert für bestimmte Ionen oder Ionengruppen.
Pestizide
Diese werden chromatographisch bestimmt, zum Beispiel durch HPLC
(Hochdruck-Flüssigchromatographie) oder GC-MS-Kopplung (Gaschromatographische Auftrennung mit
anschließender Peak-Identifikation im Massespektrographen). Man kann auch Antikörperbildung
zur Identifikation heranziehen (Immun-Assay).
Schwermetalle
AAS (Atomabsorptions-Spektroskopie)
Bei der AAS nutzt man aus, dass jedes Element im
dampfförmigen Zustand Spektrallinien bestimmter
Wellenlängen absorbiert (Natrium z. B. eine gelbe Doppellinie
bei 589,3 nm). Andererseits wird das gleiche Licht bei noch
höherer Anregung wieder emittiert (Natriumdampflampen an
Straßenkreuzungen). Den Dampf erzeugt man, indem man die
Verbindung in eine heiße, farblose Flamme sprüht. Man schickt durch diese
Flamme gebündeltes Licht aus einer Lampe, deren
Strahlenquelle gerade das Element enthält, das man
bestimmen will. Dieses Licht wird in Abhängigkeit von der
Konzentration des Metalls teilweise absorbiert, der Rest fotometrisch bestimmt.
Aus dem Umfang der Absorption kann die
Konzentration berechnet werden.
1.1.7 Reinigung von Abwasser in der Kläranlage
Die folgende Übersicht kann nur die wichtigsten Reinigungsstufen ansprechen.
| - | Mechanische Stufe:
Mit Rechen und durch Absetzen trennt man schwere Schwebeteile und schwimmende Stoffe (Windeln, Zigarettenkippen). |
| - | Biologische Stufe (Belebungsstufe):
"Belebtschlamm" enthält die eigentlichen Reiniger des Abwassers, die Mikroorganismen. Diese mineralisieren organischen Schmutz. Dabei muss für ausreichende Belüftung gesorgt werden. |
| - | Denitrifikationsstufe bei hoher Nitratbelastung:
Organische Substanzen werden von speziellen Bakterien mit Nitrat-Ionen oxidiert, wobei Stickstoff entsteht. |
| - | Phosphatentfernung (Chemische Reinigungsstufe):
Durch Fällung mit Eisen(III)- oder Aluminiumsalzen. |
| - | Adsorptive Reinigung des klaren Wassers:
Durch Aktivkohlefilter entfernt man CKW und andere biologisch nicht abbaubare Chemikalien. |
| - | Klärschlammbehandlung:
Erhitzen auf 60 °C tötet unkontrollierte Keime ab. Im Faulturm schließt an diese thermophile Phase die Stabilisierungsphase unter Entwicklung von Faulgas (Biogas) an. Dabei wird der Klärschlamm geruchsfrei. |