5.6 Korrosion und Korrosionsschutz
Grund für die riesige Weltproduktion von Eisen ist nicht ständige Neukonstruktion von Anlagen, sondern Ersatz für korrodierte Bauteile.
So dienen in den USA 40 % der jährlichen Stahlproduktion zum Ersatz von Korrosionsschäden. Damit gehen 4,2 % des Bruttosozialprodukts verloren. In der BRD waren das 1978 45 Milliarden DM. (Die Tendenz ist steigend.)
5.6.1 Chemische Vorgänge bei der Korrosion
Corrodere ist lat. anfressen. Korrosion ist die chemische Reaktion eines metallischen Werkstoffs mit Chemikalien aus seiner Umgebung in Gegenwart von Wasser.
Der Grund für die Korrosion liegt in der Instabilität von den als Werkstoffen benutzten unedlen Metallen gegenüber Sauerstoff, Wasser und Elektrolyten - einer Mischung, die zunehmend im Sauren Regen zu finden ist.
Korrosion ist als Redoxphänomen zu deuten und ist eng mit elektrochemischen Prozessen verbunden.
Das Stichwort heißt Lokalelement. Hierunter versteht man den Kurzschluss von Metallen unterschiedlicher Elektronegativität in Gegenwart von Wasser. Dies können z. B. Eisen und Kupfer sein - Beispiel: Ein Eisendach, das mit Kupfernägeln befestigt wird, wird an den Berührungspunkten rasch korrodieren. Das Modell gilt aber auch für Kontaktstellen stark verschiedener Eisenlegierungen, wie sie z. B. in Knautschzonen beim Auto vorkommen.

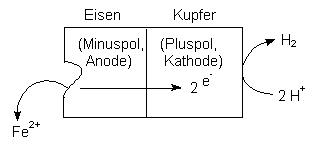
Abb. 20: Ablauf der Säurekorrosion
Säurekorrosion (-> Abb. 20)
Kupfer katalysiert die Korrosion von Eisen. Cu zieht als stärker
elektronegatives Element Elektronen aus Eisen an (ist also Pluspol)
und baut sie in das eigene Metallgitter ein. Formal gilt:
Eisen wird als oxidierender Pol Anode, Kupfer als reduzierender Pol Kathode. (Die Begriffe Anode und Kathode haben somit nichts mit dem Vorzeichen der Polung zu tun. Anodische Vorgänge sind letztlich immer oxidierend, kathodische reduzierend.)
Das umgebende Wasser liegt teilweise dissoziiert vor:
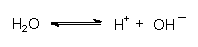
An der negativ geladenen Cu-Oberfläche werden die Wasserstoff-Ionen unter Bildung von Wasserstoff entladen:
Die positiven Überschussladungen am Eisen werden als Ionen abgegeben. Dies wird durch Bildung von Eisenhydroxiden mit den aus der Wasserdissoziation stammenden OH¯-Ionen unterstützt:
Die Säurekorrosion läuft also ohne Beteiligung von elementarem Sauerstoff ab.
(Der Effekt der Säurekorrosion in Abb. 20 ist übrigens die Grundlage der Technologie galvanischer Elemente: Trennt man die Kurzschlussstelle und verbindet man sie leitend über einen Verbraucher, kann man den fließenden Strom zur Arbeitsleistung heranziehen. Strom(dichte) und Materieabbau hängen zusammen: 1 mA/cm2 entspricht einer jährlichen Korrosionsrate von 11 mm Eisen.)
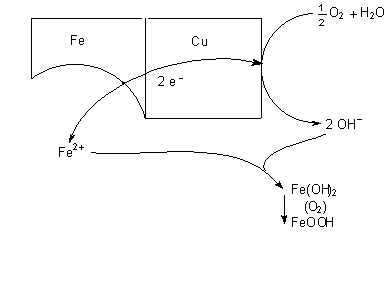
Abb. 21: Katalysierte Sauerstoffkorrosion
Sauerstoffkorrosion (-> Abb. 21)
Die Korrosionsprozesse fördernden OH¯-Ionen können auch unter
Beteiligung von elementarem Luftsauerstoff gebildet werden, der
am edleren Metall (Kupfer) mit den überschüssigen Elektronen
reduziert wird:
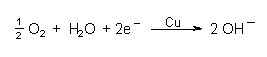
Dabei oxidiert der Sauerstoff Fe(II)-hydroxid zu FeOOH, dem gefürchteten Rost.
Korrosion und Umwelt
Korrosionsschäden treffen nicht nur das Werkstück, sondern auch
die Umgebung. Beispielsweise werden Schwermetalle, die als
Oberflächenschutz dienen sollten, mobilisiert. Aber auch Eisen(II)-Salzlösungen,
die die Sauerstoffbilanz von Gewässern stören und
diese versauern, gelangen in die Umwelt. (Eisen(III)-Ionen sind
außerdem sog. Kationensäuren.)
5.6.2 Korrosionsschutzmaßnahmen
Angepasste Materialauswahl
Beispiele sind Al/Mg-Legierungen im Flugzeugbau. Beide Metalle
sind extrem unedel, überziehen sich aber mit einem dünnsten Film
von inertem Oxid (Passivierung). Gleiches gilt für Titan als Ersatz
für Kupfer bei möglichst dünnwandigen Wärmeaustauschern in
Wärmekraftwerken. In diesem Zusammenhang ist auch Chrom zu
nennen, das Eisen in neutraler Umgebung wegen der Bildung von
inertem Chrom(III)-oxid schützt. Dagegen ist es in saurer
Umgebung unedler als Eisen und fördert nach Auflösung die
Korrosion des Werkstücks (Ausblühen).
Oberflächenveränderung durch metallische Überzüge
Beispiele sind Galvanisieren, Plattieren, Aufdampfen, Feuerverzinken.
Galvanisieren ist die elektrolytische Abscheidung von metallischen Überzügen auf unterschiedlichen Werkstoffen, vorwiegend Metallen oder auf mit Graphit elektrisch leitend gemachten Nichtleitern (Kunststoffe). Dabei erhält man Verbundwerkstoffe mit Oberflächeneigenschaften, die das Grundmaterial überhaupt nicht oder zumindest nicht in dieser Güte aufweist. Wichtige Metalle, die galvanisch abgeschieden werden, sind Kupfer, Nickel, Zink, Cadmium, Chrom, Zinn, Silber und Gold.
Plattieren, der weitaus bedeutendste Prozess zum Korrosionsschutz, ist der direkte Auftrag einer Metallschicht auf ein Werkstück (z. B. durch Walzen, Sprengung etc...).
Aufdampfen erfolgt im Vakuum. Beim Feuerverzinken taucht man das Werkstück in flüssiges Zinkmetall.
Oberflächenveränderung durch nichtmetallische Überzüge
Überzüge sollen Wasser und Sauerstoff abhalten, sind also häufig
Lacke, die mit oder ohne Lösemittel aufgetragen werden.
Weitere Beispiele sind Aufschlämmungen von Pigmenten wie
Mennige Pb3O4 oder anderen oxidierenden Schwermetalloxiden.
Bekannt sind auch künstliche Oxidüberzüge. Hierzu elektrolysiert
man Aluminium in Oxalsäurelösungen und verstärkt dessen
Passivierung (anodische Passivierung, Eloxieren).
Rostumwandler enthalten Phosphorsäure. Diese wandelt unter Mitwirkung von Netzmitteln (Tensiden) Rost in stärker haftendes Eisenphosphat um - mit aufschiebender Wirkung.
Beim Auto wird deutlich, was die Überzüge leisten müssen. Sie müssen stabil sein gegen:
| - | mechanische Beanspruchungen (Kratzer, Schwingungen), |
| - | Lösemittel wie Benzin und Öl, |
| - | chemische Beanspruchungen, vor allem:
elektrolythaltige Feuchtigkeit (Salzwasser, saurer Regen), UV-Strahlung, extreme Temperaturwechsel. |
Kathodischer Korrosionsschutz
Das Werkstück (z. B. Eisen) wird durch bewusst korrodierenden
Kontakt mit einem unedleren Metall (wie Mg) kathodisch geschaltet
(-> Abb. 22). Damit wird die Abgabe von Fe-Ionen verhindert und
die Rostbildung unterbunden. Da hierbei das andere Metall oxidiert
wird, bezeichnet man dieses als Opferanode. Dieses Verfahren
spielt beim Rostschutz von Schiffen, aber auch von Heizungsanlagen eine
wichtige Rolle. Viele Hausheizungen verfügen
darüber, ohne dass die Besitzer dies wissen und so die Erneuerung
versäumen.
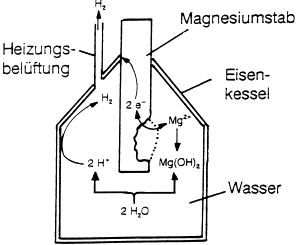
Abb. 22: Opferanode
Man kann auch direkt negativen Gleichstrom an das von Korrosion bedrohte Werkstück legen. So verfährt man z. B. bei der neuen Mittelland-Kanal-Weserbrücke in Minden.
Schutz durch Inhibitoren und andere Maßnahmen
Durch Unterdruckbehandlung entgast man Heißwasser und befreit
es von Sauerstoff und säurebildendem CO2. Letzte Reste beseitigt
man mit Reduktionsmitteln wie Hydrazin N2H4. Darüber hinaus muss
Wasser total entsalzt werden (Ionenaustauscher). Schwefelwasserstoff
entfernt man durch Oxidation mit Wasserperoxid H2O2
(-> 6.2.4).
5.6.3 Korrosionsschutz und Umwelt
Besonders wichtig für die Umwelt ist der Schutz durch metallische Überzüge, da hier Schwermetalle wie Sn, Cr, Cu, Ni, Mn, Zn und Cd eingesetzt werden. Dabei wirken Cr, Sn und Ni besonders aufgrund ihrer Passivierung, während Zn als Opferanode dient. Wird bei edleren Eisenschutzmetallen wie z. B. Sn und Cr in saurem Milieu der Überzug verletzt, beginnt die Korrosion des Eisens erst recht (Ausblühen von verzinnten Dosen, von verchromten Stoßstangen). Mit dem abblätternden Rost gelangen die Schwermetalle in die Umwelt.
Aber auch die Galvanotechnik selbst ist nicht unproblematisch. Früher gab es da eine Menge Möglichkeiten für das Entstehen von Umweltschäden. Einige Beispiele: Zunächst musste das Eisenstück, das zuvor gegen spontane Rostbildung nach dem Gießen/Schmieden sofort in ein Ölbad getaucht wurde, total entfettet werden. Dies geschah mit CKW, die über den Luftpfad und anderen Wegen sogar ins Grundwasser gelangten. Sie stellen als Altlasten noch heute Probleme für die Trinkwassergewinnung dar, die den Einsatz von Aktivkohlefiltern notwendig machen.
Beim Verchromen setzte man schwefelsaure Lösungen von toxischem Natriumdichromat oder sogar Chromtrioxid ein. Beim Cadmieren muss man giftige Cadmiumverbindungen nutzen. Weitere wichtige, umweltbelastende Stoffe, die in der Galvanotechnik eine große Rolle spielten sind vor allem die Cyanide. Das ist notwendig, um im alkalischen Milieu arbeiten zu können. Denn hier sind die Überzüge besonders gleichmäßig und stabil. In diesem Milieu bilden sich aber schwerlösliche Hydroxide. Das verhindert man durch Zusatz von Kaliumcyanid. Es kommt bei Zn, Cu, Ag und Au zur Bildung von Komplexen, aus denen heraus die Abscheidung der Metalle erfolgt.
Da die galvanisierten Werkstücke besonders gut abgespült werden müssen, werden große Mengen von Reinwasser hoher Qualität benötigt. Außerdem sind die Abwässer von Galvanisieranlagen stark belastet.
Man muss aber deutlich sagen, dass die geschilderten Schäden bei der Galvanotechnik heute mehr und mehr vermieden werden können. Natürlich geschah das wohl nur unter dem mehr oder weniger starken Druck von Öffentlichkeit und Gesetzgeber. Bei uns in der Bachaue zum Beispiel schwammen merkwürdigerweise immer am Wochenende häufig die Fische kieloben - weil wieder einmal irgendein Bielefelder Galvanikbetrieb Cyanid abgelassen hatte. Warum taten die das gerade am Wochenende? Da genossen die Mitarbeiter der Gewerbeaufsicht ihre wohlverdiente Freizeit.
Trotzdem entwickelte man Verfahren, bei denen man ohne Cyanid oder korrosionshemmendes Sulfit auskommt.
Die Abwässer werden heute gereinigt und im Kreislauf genutzt. Das ist sogar auch wirtschaftlich von Vorteil: Dabei
spart man nicht nur Wasser- und Entsorgungskosten, sondern gewinnt im Sinne des Recyclings Wertstoffe zurück.
Aber anzunehmen, dass die Entfernung von Schadstoffen vollständig gelänge, ist naiv. So kann man zwar versuchen, Cyanid zu oxidieren. Schwermetalle kann man mit spezifischen Ionenaustauschern herausholen. Aber dennoch sind unvermeidlich Reste von Schadstoffen im Abwasser enthalten. Für deren Nachweis bieten übrigens auch heute noch einschlägige Firmen „Kits“ für schnell durchzuführende Prüfungen an (auch wenn das nach Meinung von Galvanik-Experten gar nicht nötig wäre…).
Auf den Einsatz von CKW verzichtet man ganz.
Problematischer denn je sind aber die perfluorierten Tenside, die für „Sofortglanz“ ohne Politur sorgen sollen. Diese sind unter dem Kürzel PFT bekannt. Dass sie durch Unachtsamkeit oder kriminelle Energie auf die Felder gelangt sind, sorgt für anhaltende Diskussionen. Denn sie sind biologisch nicht abbaubar und reichern sich deshalb in den Organismen an, also auch im Menschen - die Folgen sind nicht absehbar.
Immerhin gilt die deutsche Galvanik-Industrie quasi als Musterknabe für umweltschonende Technologien - vorausgesetzt, es halten sich alle an die Vorgaben. Das wird wohl leider nicht immer der Fall sein, vor allem, wenn wir weniger entwickelte Länder in unserer globalen Welt betrachten, in denen auch unsere Firmen produzieren lassen.
5.6.4 Reinigung der Galvanikabwässer
| Tab. 5: |
Grenzwerte für einige Schwermetalle im Trinkwasser
(Trinkwasserverordnung von 1986) |
| Metall | Grenzwert |
| Cadmium
Chrom Nickel Kupfer Zink |
0,005 mg/l
0,05 mg/l 0,05 mg/l kein Grenzwert festgelegt kein Grenzwert festgelegt |

Es ist aus diesen Gründen anzustreben, die Inhaltsstoffe aus den anfallenden Abwässern quantitativ zu entfernen. Das gereinigte Wasser kann wieder für das Ansetzen von Elektrolytbädern oder als Spülwasser verwendet werden, durchläuft also einen betriebsinternen Kreislauf. Die organischen Materialien werden adsorbiert, die Metallsalze aufkonzentriert und der Galvanik erneut zugeführt, wodurch die Rohstoffverluste minimiert werden.
Gegenwärtig werden zur Entfernung der Schwermetall-Ionen aus dem Abwasser hauptsächlich folgende Verfahren angewandt:
Fällung
Ein typisches Fällungsreagenz ist Schwefelwasserstoff, mit dem
z. B. aus cadmiumhaltigen Elektrolyten Cadmiumsulfid abgeschieden wird.
Durch Zusatz von Laugen werden Metall-Ionen wie
Ni2+ in schwerlösliche Hydroxide überführt.
Eine vollständige Entfernung gelingt prinzipiell nicht (Aussage des
Massenwirkungsgesetzes;
Anwendung des Löslichkeitsprodukts).
Außerdem wird das Abfallproblem oft nur verlagert, da die stark giftigen Niederschläge
deponiert werden müssen. Die Umweltbelastung ist folglich
sehr hoch.
Elektrolytische Reinigung
Für die Behandlung höher konzentrierter Abwässer
(z. B. unbrauchbar gewordene Galvanisierbäder) werden elektrolytische
Verfahren eingesetzt. Hier ist eine hohe Abscheidungsrate möglich.
Ionenaustausch
Die Hauptmenge der galvanischen Abwässer stellen Spülwässer mit
einer geringen Elektrolytkonzentration dar. Für deren Aufkonzentrierung
werden Ionenaustauscher eingesetzt. Durch Regenerierung
der Ionenaustauscher erhält man Lösungen hoher Schwermetallsalzkonzentration,
aus denen die Metalle entweder elektrolytisch
abgeschieden oder in einigen Fällen direkt in die Galvanisierbäder
zurückgeführt werden.
Ionenaustauscher sind im Allgemeinen feste Stoffe, die aus einer Elektrolytlösung positive oder negative Ionen aufnehmen und im Austausch dafür eine äquivalente Menge anderer Ionen gleichen Vorzeichens an die Lösung abgeben können. Je nach Vorzeichen der austauschbaren Ionen unterscheidet man Kationen- oder Anionenaustauscher (-> Abb. 23).
Ionenaustauscher bestehen aus einem Molekülgerüst (Matrix), das negativ oder positiv geladene Gruppen (Ankergruppen) trägt. Für jede Ankergruppe enthält der Austauscher aus Gründen der Elektroneutralität eine entsprechende Zahl von Gegen-Ionen. Gibt man eine Schwermetallsalzlösung auf den Austauscher, so können im Fall z. B. eines Kationenaustauschers die dort gebundenen Kationen in einer Gleichgewichtsreaktion gegen die der Salzlösung ausgetauscht werden. Anionenaustauscher verwendet man zur Abtrennung von nicht umgesetzten Chromat-Ionen.
Besonders gut und dabei spezifisch kann Cadmium mit einem chelatbildenden Ionenaustauscher aus den anfallenden Lösungen entfernt werden.
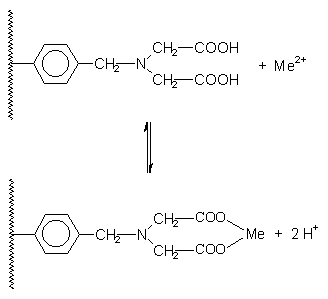
Abb. 23: Prinzip eines Kationenaustauschers
Adsorption
Reste von Schwermetall-Ionen können zusammen mit Tensiden und
CKW-Spuren durch Adsorption an Aktivkohle entfernt werden. Auch
hierbei entstehen größere Abfallmengen.
Dialyse
In neuester Zeit trennt man zunehmend Ionen und Tenside aus dem
Abwasser mit Hilfe von halbdurchlässigen Membranen ab. Die
Metalle und Tenside werden dabei aufkonzentriert und können
leicht zurückgewonnen werden. Das reine Wasser geht wieder in
den Kreislauf.
In der folgenden Tab. werden nochmals die gängigen Verfahren der Aufbereitung galvanischer Abwässer gegenübergestellt. Der Vergleich zeigt deutlich die Vorteile des Ionenaustauschers.
| Tab. 6: | Vergleich verschiedener Verfahren zur
Abwasseraufbereitung in der Galvanotechnik |
| Verfahren | Vorteile | Nachteile |
|---|---|---|
| Fällung | Niedrige Anlagekosten.
Weitgehende Entgiftung des Abwassers. |
Hoher Aufwand an zusätzlichen
Entgiftungschemikalien.
Umweltprobleme durch anfallende Schlämme, die auf Sonderdeponien gelagert werden müssen. Geringe Möglichkeit zur wirtschaftlichen Rückgewinnung der Wertstoffe. |
| Elektrolyse | Rückgewinnung der Metalle.
Kein Aufsalzen der Abwässer. |
Abwässer müssen wegen geringer Metallkonzentration
zunächst aufkonzentriert werden. Hohe Restkonzentration in den elektrolysierten Lösungen. |
| Ionen-
austausch |
Besonders geeignet für die
Aufbereitung großer Abwassermengen mit geringer Elektrolytkonzentration.
Metalle und Wasser werden zurückgewonnen. |
Zusätzliche Chemikalien für die Regenerierung notwendig, die teilweise nicht wieder verwendet werden können. |
| Adsorption | Entfernung von Tensiden, Schwermetallresten. | Fester Abfall muss auf Sonderdeponien gelagert werden. |
| Dialyse | Entfernung von Tensiden, Schwermetallresten, kaum Abfall. | — |