Modellversuch zum Claus-Prozess
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Bei diesem Verfahren wird Schwefelwasserstoff, der bei der Druckgasentschwefelung
anfällt, in einer Symproportionierungsreaktion zu elementarem
Schwefel oxidiert. In der Praxis verbrennt man ein Drittel des
anfallenden Schwefelwasserstoffs mit Luftsauerstoff zu Schwefeldioxid:
Das entstandene Schwefeldioxid lässt man mit dem restlichen Schwefelwasserstoff reagieren. Unter der Einwirkung von Wasser als Katalysator läuft dabei folgende autokatalytische, exotherme Symproportionierungsreaktion ab:
| Kat. | ||
|
|
|
|

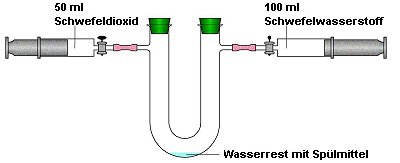
Bild 1: Aufbau zum Modellversuch zum ClausProzess
(Quelle: Cornelsen)
Geräte
Siehe Versuchsanordnung (Skizze).
Chemikalien
Schwefelwasserstoff (F, T+), Schwefeldioxid (T),
Pril, dest. Wasser.
Vorschriften zur Herstellung der Schadgase:
Schwefeldioxid
Schwefelwasserstoff
Durchführung
Man füllt je einen trockenen Kolbenprober zu einem Drittel
mit Schwefeldioxid und zu zwei Dritteln mit Schwefelwasserstoff.
Die Gase werden beginnend mit dem SO2 langsam
in das URohr geschoben, das als Katalysator etwas Wasser
mit Pril enthält.
Pril sorgt für Vergrößerung der
benetzten Glasoberfläche. (Deshalb muss das URohr zuvor
damit ausgespült werden.) Es bilden
sich rasch weiße Nebel,
die sich an der Glaswand als gelbe Masse niederschlagen: Schwefel
und Kondenswasser.

Bild 2 (Foto: Daggi)
Hinweise
1. Man sollte nicht zuviel Wasser ins U-Rohr füllen, damit die Gase nicht gegenseitig abgesperrt
werden.
2. Wenn man keine Gase hat, kann man stattdessen in einem Reagenzglas Lösungen von Natriumsulfid (C,N) und von Natrium(bi)sulfit (Xn) mischen.