Schwefelwasserstoff
Schwefelwasserstoff ist sehr giftig
Schwefelwasserstoff H2S wird nicht nur bezüglich seiner Verbreitung, sondern auch
der Vielfalt seiner Wirkungen unterschätzt. So ist es ein gefährliches Nervengift, das
rasch zur Atemlähmung führen kann. Obwohl Schwefelwasserstoff giftiger als
Blausäure HCN ist, sind durch Schwefelwasserstoff verursachte akute
Vergiftungserscheinungen in der Allgemeinheit kaum bekannt. (Die letale Dosis für
Blausäure beträgt 0,7 mg/kg Körpergewicht, für Schwefelwasserstoff nur 0,5 mg/kg.)
Offenbar liegt die Geruchsschwelle dieser unangenehmen Verbindung wesentlich
niedriger als die der Blausäure, deren angenehmen Mandelgeruch manche Personen
überhaupt nicht wahrnehmen. Konzentriertes H2S erscheint übrigens wegen der
Schädigung der Geruchsnerven geruchlos.
Entstehung von H2S
Vulkanismus
Viele Vulkane wie zum Beispiel der Versuv enthalten in ihren Abgasen neben
Schwefeldioxid auch große Mengen von Schwefelwasserstoff. Hierher rühren auch die
Schwefelwasserstoffanteile in manchen Heilbädern.
Anaerobe Fäulnisprozesse
In der Natur wird Schwefelwasserstoff hauptsächlich bei der Zersetzung organischer,
schwefelhaltiger Materialien wie die Proteine freigesetzt (Geruch nach faulen Eiern).
Menschen und Tiere emittieren mit Atemluft und Darmgasen deshalb stets Schwefelwasserstoff.
Aber auch Biogasanlagen setzen das giftige Gas frei.
Eine weitere Quelle für H2S sind Sulfat-Ionen, welche als Oxidationsmittel an die Stelle des Sauerstoffs treten und durch anaerobe Bakterien (Desulfurikanten) unter Energiefreisetzung reduziert werden:
SO42- + 8 [H] + 2 H+ ———> H2S + 4 H2O
(Das Symbol [H] bezeichnet biochemische Reduktionsäquivalente wie etwa NADH.)
Übrigens können parallel dazu durch Bakterien auch Eisen(III)-Verbindungen reduziert werden:
Fe3+ + [H] ———> Fe2+ + H+
Schwefelwasserstoff und Eisen(II)-Ionen bilden den in Ton, Kreide- und Kalksedimenten sowie in Kohle reichlich enthaltenen, aber ökologisch bedenklichen Pyrit (FeS2) bzw. dessen instabile Vorstufe Markasit (Katzengold). Somit ist das Vorkommen von Katzengold in Sedimentgesteinen immer ein Hinweis auf frühere anaerobe Fäulnisprozesse. Heute beobachtet man diesen Vorgang wieder in eutrophierten Gewässern oder umgekippten Tiefengewässern wie der Ostsee oder dem Schwarzen Meer.
Technisch bedingte Emissionen
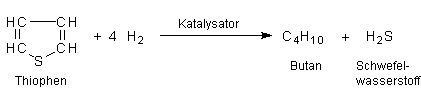
In der Technik fällt Schwefelwasserstoff in riesigen Mengen vor allem als Produkt
eines Präventivverfahrens zur Entfernung von Schwefel aus Brennstoffen, der
Druckentschwefelung, an. Hierbei lässt man auf die Brennstoffe (vor allem
Erdölprodukte wie Diesel- oder Heizöl sowie Kerosin) Wasserstoff in Gegenwart eines
Katalysators einwirken. Es entstehen Schwefelwasserstoff und Kohlenwasserstoffe;
aus dem typischen Erdölbestandteil Thiophen wird so Butan:

Weitere starke Emissionen beobachtet man bei dem Holzaufschluss nach dem Sulfatverfahren. Erdgas (wie in Südfrankreich oder in Rußland) besteht manchmal fast zur Hälfte aus Schwefelwasserstoff.
Lästig, wenn auch weit unterhalb der Schadensgrenze, ist die Freisetzung von H2S durch Kat-Autos. Hiervon sind auch geregelte Katalysatoren betroffen. Der Grund dafür ist, da die Katalysatoren zu gut arbeiten und Schwefelreste in den Treibstoffen reduzieren.
Physiologische Wirkungen von H2S
a Schwefelwasserstoff reagiert mit Thiolgruppen
oxidativ unter Disulfidbildung:
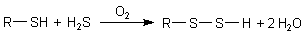
Werden hiervon Peptidhormone oder aktive Zentren von Enzymen oder Redoxschutzstoffe wie Glutathion (GSH) betroffen, so bedeutet dies den absoluten Verlust der spezifischen Funktion dieser Stoffe.
b Schwefelwasserstoff öffnet Disulfidbrücken, wodurch sich die Gesamtstruktur (Konfiguration) von Peptid- oder Proteinmolekülen verändert. Diese verlieren dadurch ihre Funktion.
R-S-S-R + H2S ———> R-S-S-H + H-S-R
Dies betrifft vor allem Enzyme, membrangebundene Proteine mit Transporteigenschaften sowie Peptidhormone wie das Insulin. (In diesem Zusammenhang sei auch an die chemischen Vorgänge bei der Dauerwelle erinnert. Hier setzt man zur Öffnung der Disulfidbrücken des Haarproteins Keratin nicht Schwefelwasserstoff, sondern die allergenisierende Thioglykolsäure oder neuerdings auch die harmlose Aminosäure Cystein ein.)
c Typisch für Schwefelwasserstoff ist die Bildung von stabilen Schwermetallsulfiden. Hierdurch werden Enzyme, die für den Stoffwechsel essentielle Schwermetall-Ionen wie Cu2+ oder Zn2+ enthalten, blockiert. Beispiele sind Enzyme zur Verwertung von Eisen sowie die Alkoholdehydrogenase oder die Carboanhydrase, die die Einstellung des Gleichgewichts zwischen Kohlendioxid/Wasser und Kohlensäure beschleunigt. (Auf Metallsulfidbildung beruht auch die Nachdunklung von Gemälden, die mit hellen Bleifarben, z. B. Bleiweiß, gemalt wurden.)
d Schwefelwasserstoff bildet Komplexe mit Eisen-Ionen. Dabei kann dieser andere Liganden wie Wasser oder Sauerstoff verdrängen und dabei recht feste Bindungen eingehen. Hieraus erklärt sich die wichtigste Giftwirkung auf aerobe Organismen, die Störung der Zellatmung: Durch die Komplexbildung sind neben dem Hämoglobin vor allem die Eisen-Ionen enthaltenden Cytochrome und wichtige Enzyme der Atmungskette wie die Cytochromoxidase betroffen. Dies betrifft nur aerobe Organismen wie die Fische, so da die Lebensfeindlichkeit faulender Gewässer als Folge der Überdüngung (Eutrophierung) verständlich wird.
e Hinzu kommt, da die Oxidation des Reduktionsmittels Schwefelwasserstoff in Abwässern zu einer Verarmung an Sauerstoff führt. Das führt zu hohen COD-Werten.
f Weiter ist Schwefelwasserstoff ein wichtiges Quellgas, das unter Verbrauch von HO-Radikalen SO2 bildet.
H2S + HO· ———> HS· + H2O
HS· + O2 ———> SO + HO·
SO + O2 / NO2 / O3 ———> SO2
Korrosionswirkung von Schwefelwasserstoff
Schwefelwasserstoff fördert in Lösung bei Anwesenheit von Luft die Korrosion,
obgleich er in Wasser nur eine sehr schwache Säure ist:
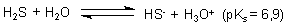
Der Grund ist, dass Schwefelwasserstoff durch die Bildung von Schwermetallsulfiden anodische (d. h. oxidative) Prozesse fördert.
Ein bekanntes Beispiel ist Silber, das in Gegenwart von Schwefelwasserstoff oxidiert wird ("anläuft"). Dies sollte eigentlich wegen der fast gleichen Standardpotentiale (E) von Sauerstoff und Silber gar nicht möglich sein:
Red: ½ O2 + H2O + 2 e- ———> 2 OH-; E = 0,828 V
Ox: 2 Ag ———> 2 Ag+ + 2 e-; E = 0,799 V
Bei Anwesenheit von Schwefelwasserstoff verringert sich der E-Wert des Silbers aufgrund der bei der Bildung des schwerlöslichen Sulfids freigesetzten "Freien Energie" beträchtlich:
Ox: 2 Ag + H2S ———> Ag2S + 2 H+ + 2 e-; E = 0,037 V
Nun kann aufgrund der großen Potentialdifferenz zu Sauerstoff die Oxidation des Silbers erfolgen.
Nicht nur H2S selbst wirkt korrosiv. Mikroorganismen (Sulfurikante) im Abwasser oxidieren ihn zu Schwefelsäure. Letztlich ist das eine Reaktion, die entgegengesetzt der oben beschriebenen Reaktion verläuft, mit der Desulfurikanten biochemisch aus Sulfat-Ionen Schwefelwasserstoff herstellen:
H2S + 4 H2O ———> SO42- + 8 [H] + 2 H+
(Das Symbol [H] bezeichnet auch hier biochemische Reduktionsäquivalente wie etwa NADH.)
Da Schwefelsäure wesentlich saurer ist als Schwefelwasserstoff, fördert sie die Korrosionsprozesse zusätzlich.
Minderung der Emission von H2S
Die Emission von Schwefelwasserstoff war einer der Auslöser zur Abkehr vom
Leblanc-Verfahren zur Sodaherstellung.
Zur Substitution führte man das gänzlich neue Solvay-Verfahren ein. Dies ist ein Beispiel für frühe Versuche,
durch Entwicklung umweltverträglicher Verfahren präventiv zu wirken.
Der industriellen Emission von Schwefelwasserstoff begegnet man heute entweder durch Verbrennen zu Schwefeldioxid oder durch Symproportionierungsreaktionen wie dem Claus-Prozess, bei dem große Mengen an Schwefel, einer wertvollen Industriechemikalie, anfallen.

Zur Desodorierung von Abwässern und Klärschlämmen setzt man als Oxidationsmittel
besonders Wasserstoffperoxid ein. Hierdurch werden auch Metallsulfide oxidiert. Es
bilden sich dabei Sulfate.
Eine wichtige Präventivmaßnahme ist auch die Verhinderung der Eutrophierung und
des "Umkippens" von Gewässern.
Weitere Texte zum Thema „Abgas“