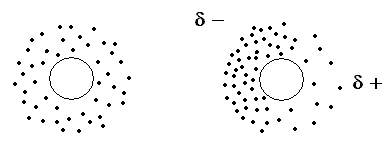
Die Van-der-Waals-Bindungen - Kleber der unpolaren Moleküle
Die Moleküle der Kohlenwasserstoffe sind unpolar. Trotzdem ist der Zusammenhalt zwischen längeren Kohlenwasserstoffketten größer als der zwischen kürzeren Molekülen. Es müssen also Kräfte existieren, die eine Anziehung zwischen augenscheinlich unpolaren Molekülen herstellen. Zum Verständnis dieser Kräfte muss man sich daran erinnern, dass auch ein unpolares Molekül aus geladenen Bausteinen besteht. Die negativen Ladungsträger, die Elektronen, kann man sich als eine Wolke (Elektronenwolke) vorstellen, die sich um die Atomkerne des Moleküls herum erstreckt. Die Verteilung der Elektronen in dieser Wolke ist nicht ständig gleich. Die Elektronen können sich zu bestimmten Zeitpunkten mal mehr in der einen Richtung befinden, mal mehr in der anderen.

Zu solchen Zeitpunkten bildet sich also eine kurzzeitige Polarität in dem Molekül aus, die wiederum prompt eine Ladungsverschiebung in den anliegenden Atomen und Molekülen verursacht.
Aufgrund der kurzen Lebensdauer dieser Dipole bilden sich zwischen ihnen schwache Anziehungskräfte aus. Diese Kräfte heißen Van-der-Waals-Kräfte. Sie sind nach dem niederländischen Physiker Johannes D. van der Waals (1837-1923) benannt, der für die Entdeckung dieser Wechselwirkungen 1910 den Nobelpreis erhielt. Der Forscher erklärte damit allerdings zunächst das Verhalten von realen Gasen.
Je größer nun das Molekül ist, je mehr Elektronen damit vorhanden sind, umso polarer können die Moleküle kurzfristig werden und umso stärker sind damit die Van-der-Waals-Bindungen.


Bild 1: Isomere des Pentans: Links n-Pentan, rechts Isopentan (Tetramethylmethan)
(Fotos: Daggi)
Dadurch wird ihre Oberfläche kleiner, die Berührungsmöglichkeiten mit anderen Molekülen werden
reduziert und somit auch die Stärke der Van-der-Waals-Bindung vermindert.
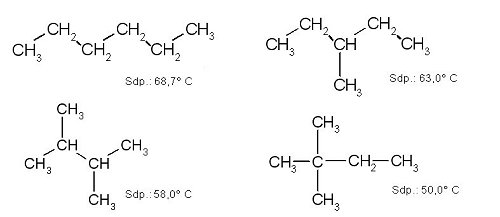
Dass der Zusammenhalt zwischen verzweigten Molekülen tatsächlich geringer ist, erkennt man durch einen Vergleich der Schmelz- und Siedepunkte isomerer unverzweigter und verzweigter Alkane. Wir zeigen das am Beispiel von vier Isomeren des Hexans.
Auch die Fähigkeit von Geckos, selbst an der Unterseite von Glasscheiben laufen zu können, beruht auf dieser Art von zwischenmolekularen Kräften. Durch eine riesige Anzahl an feinen Härchen, die sich in Lamellen angeordnet auf den Zehenunterseiten befinden, wird auch hier die Berührungsfläche so stark vergrößert, dass eine Anhaftungskraft an selbst glatten Oberflächen erreicht wird, die einem Mehrfachen des Körpergewichtes des Geckos entspricht.

Bild 2: Gecko in Südportugal
(Foto: Blume)
Und das ganz ohne Klebstoff!
Weitere Texte zum Thema „Kohlenwasserstoffe“