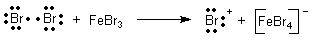
Brom ersetzt Wasserstoff - die aromatische Substitution und Zweitsubstitution
Benzol reagiert nicht so leicht mit elementarem Brom, wie man es von der Doppelbindung der Alkene
kennt (-> Versuch). Auch die Belichtung (wie bei den Alkanen) reicht nicht aus.
Durch seine energiearme mesomere Anordnung des π-Elektronensystems ist es besonders stabil.
Um an diesem starken Zusammenhalt des Elektronensystems angreifen zu können, benötigt man auch ein sehr
starkes elektronensuchendes Teilchen, ein starkes Elektrophil. Starke Elektrophile sind beispielsweise
Kationen, also Teilchen mit Elektronenmangel.
Doch selbst bei diesem starken ionischen Angriff wird das stabile Elektronensystem des Aromaten nicht
aufgegeben, sondern sofort wieder zurückgebildet. Dieses geschieht durch Abspaltung eines Protons.
Da letztlich ein Wasserstoffatom durch ein anderes Atom oder eine Gruppe ersetzt wird, ist diese Reaktion eine
Substitution.
Die Bromierung von Benzol ist eine Katalyse
Zur Bromierung des Aromaten wird ein Überträger benötigt, der das elementare Halogenmolekül aufspaltet
und dabei das elektronensuchende Kation herstellt. Hierzu bieten sich feine Eisenspäne oder die Lösung eines
Eisen(III)-Salzes an. Letzteres ist der Katalysator. Im Falle der Zugabe von Eisen bildet er sich durch
Reaktion zwischen Eisen und Brom. Die folgende Gleichung zeigt die eigentliche Katalysereaktion.
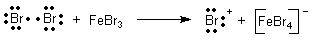
Erst dieses Kation kann das stabile π-Elektronensystem des aromatischen Kerns "knacken".
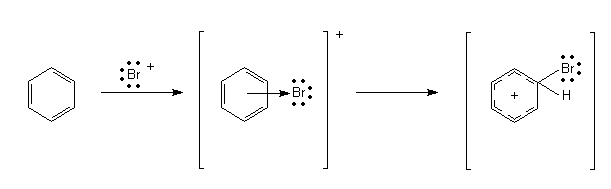
Dieser ionische Komplex ist trotz Elektronenmangels im aromatischen Kern mesomeriestabilisiert.
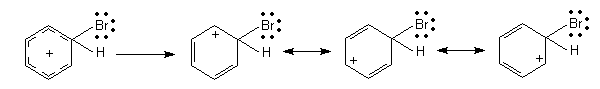
Anschließend wird das aromatische System wieder hergestellt, in dem das Proton abgespalten wird. Dieses bildet mit dem Komplexanion [FeBr4]- Bromwasserstoff (HBr) und das Eisen(III)-Salz als Katalysator zurück.
[FeBr4]- + H+ ———> FeBr3 + HBr
Die gesamte Reaktionsgleichung der Bromierung von Benzol lautet dann:
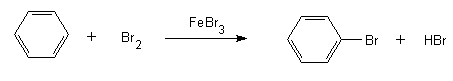
Zweitsubstitution an Brombenzol
Durch einen weiteren Reaktionsschritt können auch para- und ortho-Dibrombenzol gebildet werden.
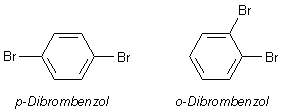
Die Bildung von ortho- und para-Dibrombenzol erfolgt aber nur in sehr geringem Umfang. Der Großteil reagiert nur bis zum einfachen Brombenzol. Denn das am Benzol gebundene Brom verringert die Reaktivität des Benzols, weil es als stark elektronegatives Element Elektronen zu sich heranzieht und so förmlich aus dem Ring saugt. Dessen Reaktivität war ja schon von vornherein sehr gering.
Weiteres zu der Wirkung von Substituenten findet man hier: Substituenten - Stellwerk und Herzschrittmacher der Aromaten.
Weitere Texte zum Thema „Kohlenwasserstoffe“