Substituenten - Herzschrittmacher und Stellwerke der Aromaten
Experimente:
Versuch: Nitrierung von Benzol
Versuch: Nitrierung von Phenol
Das aromatische System ist nicht immer so reaktionsfaul wie im Benzol. Sind
Substituenten am Ring gebunden, machen diese dem Elektronensystem oft Beine. Manche
Substituenten können aber auch die Reaktivität noch zusätzlich herabsetzen. Hinweise
dafür hatten wir schon bei der Bromierung erhalten.
Ganz besonders bei der Nitrierung eines Aromaten lässt sich erkennen, was für einen starken Einfluss die Gruppen und Reste auf die Reaktivität des Ringes (abgekürzt Ar) haben. Die Stichworte lauten "M-Effekt" und "I-Effekt".
Der M-Effekt (Mesomerie-Effekt) beschreibt, inwieweit der Substituent
auf den mesomeren Zustand des Benzolrings Einfluss nimmt. Nimmt er an der Mesomerie teil,
verstärkt er sie also, so ist es ein +M-Effekt. Im anderen Falle ist es ein -M-Effekt.
Beispiele:
+M-Effekt: Ar-OH, Ar-O-, Ar-NH2, Ar-Halogen (haben alle freie Elektronenpaare)
-M-Effekt: Ar-NO2 (Elektronenmangel am N-Atom)
Der I-Effekt (Induktiver Effekt) beschreibt, inwieweit der Substituent
Elektronen in den Kern hineinschiebt (+I-Effekt) oder herauszieht (-I-Effekt).
Beispiele:
+I-Effekt: Ar-CH3
-I-Effekt: Ar-OH, Ar-Halogen, Ar-NO2, Ar-NH3+
Alkylreste zeigen nur den +I-Effekt, da sie keine freien Elektronenpaare oder Elektronenmangel aufweisen.
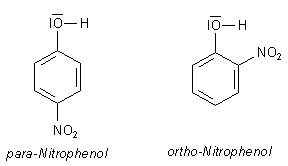
Vorneweg: Die Nitrierung von Phenol
Phenol lässt sich schon bei Raumtemperatur nitrieren und das sogar mit verdünnter Salpetersäure!
Es entstehen dabei problemlos die Isomeren ortho-Nitrophenol und para-Nitrophenol.

Den genauen Reaktionsverlauf dazu findet man hier beschrieben.
Der dort beschriebene positive Mesomerie-Effekt (+M-Effekt) der OH-Gruppe ist bei der Reaktion des Phenols die treibende Kraft, die den Kern des Aromaten angreifbar macht für elektronenliebende Substanzen wie das NO2+ der Salpetersäure. Dieses Nitryl-Kation ist (wenn auch in geringen Mengen) immer in Salpetersäure enthalten.
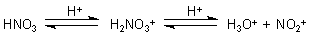
Die Nitrierung von Benzol
Benzol reagiert jedoch nicht auf so einfachem Wege zu Nitrobenzol, denn hier sind keine
+M- oder +I-Effekte ausübenden Reste vorhanden. Selbst bei
Erwärmen und mit konzentrierter Salpetersäure bleibt eine Reaktion aus. Hier muss ein Trick
angewendet werden, um die Wirkung der Salpetersäure zu verstärken.
Indem man konzentrierte Schwefelsäure zu konzentrierter Salpetersäure gibt, kann man die Konzentration an NO2+-Kationen stark erhöhen.
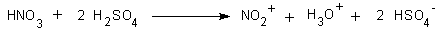
Mit dieser Mischung der beiden Säuren, die auch als Nitriersäure bekannt ist, lässt sich nun das nach bitteren Mandeln riechende, gelbe Nitrobenzol leicht darstellen.
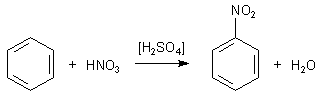

Das gelbe Öl des Nitrobenzols
(Foto: Andreas)
Wirkung von Erstsubstituenten auf die Reaktionsgeschwindigkeit
der Zweitsubstitution
Die weitere Nitrierung des Nitrobenzols stellt sich als äußerst schwierig heraus. Durch den
Auch Brombenzol geht ungern weitere Substitutionen ein (Substitution am Beispiel der Bromierung). Hier überwiegt der -I-Effekt gegenüber dem +M-Effekt.
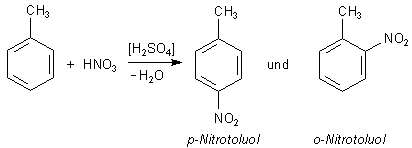
Die Nitrierung von Toluol
Ähnlich wie die OH-Gruppe des Phenols wirkt auch ein Alkylrest reaktionsbeschleunigend, allerdings wirkt
hier nur ein +I-Effekt. So reagiert Toluol um vieles leichter als Benzol zu
ortho-Nitrotoluol und para-Nitrotoluol.
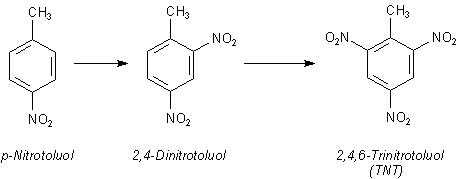
Beide Isomere können sogar bis zu 2,4,6-Trinitrotoluol weiter nitriert werden. Dieses ist unter dem Namen TNT als Sprengstoff bekannt.
Weitere Texte zum Thema „Kohlenwasserstoffe“