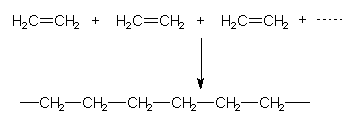
Die Polymerisation der Alkene - chemisch genauer betrachtet
Experimente:
Versuch: Herstellung von Polystyrol durch kationischen
Kettenstart
Bei der Polymerisation der Alkene und ihrer Derivate werden Doppelbindungen von ungesättigten
Monomeren geöffnet und mit anderen Doppelbindungssystemen verknüpft. Das einfachste Beispiel ist Ethen (veraltete Bezeichnung: Ethylen):
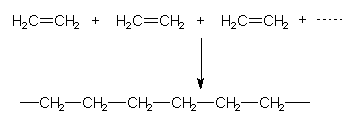
Das Polymere heißt Polyethen oder (veraltete Bezeichnung) Polyethylen.
In einer Kurzschreibweise zeichnet man nur die Monomeren sowie in einer Klammer das sich wiederholende Bauprinzip des betreffenden Kunststoffs:
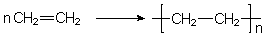
Beispiele für alkenbasierte Polymere sind:
Die in der Tabelle aufgeführten Polymere unterscheiden sich vor allem in der Art der Monomere. Letztlich sind sie (bis auf Butadien und Isopren) Abkömmlinge (Derivate) des Ethens, bei dem nur ein H-Atom durch einen anderen Rest ersetzt wurde.
Wie die Polymerisation von Alkenderivaten abläuft
Hier befassen wir uns ausschließlich mit der Polymerisation der Alkenderivate. Es handelt
sich um so genannte Additionspolymerisationen. Dabei reagieren Monomere
miteinander, ohne dass bei der Reaktion ein anderes Molekül abgespalten wird. Es gibt
verschiedene Mechanismen, um die Polymerisation einzuleiten.
Die Additionsreaktion läuft nach dem Schema einer Kettenreaktion ab. Das bedeutet, dass eine Reaktion zwischen den Monomeren einmal gestartet werden muss, dann jedoch von alleine weiterreagiert, bis alle Monomere miteinander verknüpft sind oder eine Kettenabbruchreaktion eintritt. Es gibt verschiedene Möglichkeiten zum Start der Reaktion.
Radikalische Polymerisation
Ein Beispiel ist die Polymerisation von Styrol zu Polystyrol mit Benzoylperoxid als Starter
(-> Versuch).
Im ersten Schritt wird das Peroxid so gespalten, dass beide Sauerstoffatome jeweils ein Elektron des Bindungselektronenpaares bekommen. Die dabei entstehenden ungepaarten Elektronen machen diese "Radikale" sehr reaktiv.
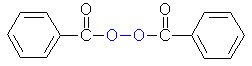
Das Radikal zerfällt unter Abgabe von Kohlenstoffdioxid in ein neues Radikal, das Phenylradikal.
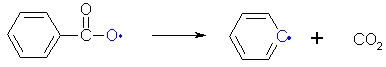
Anschließend reagiert das Phenylradikal mit einem Styrolmolekül. Dabei spaltet sich ein Elektronenpaar der Alken-Doppelbindung im Styrolmolekül. Ein Elektron bildet mit dem einzelnen Elektron des Radikals ein Bindungselektronenpaar aus, das andere Elektron bleibt allein an dem Kohlenstoffatom, das mit dem Benzolring im Styrolmolekül verbunden ist, und bildet dort erneut ein Radikal.
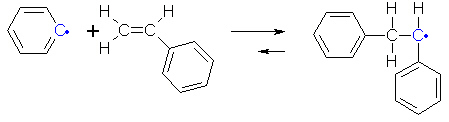
Dieses Radikal kann sich mit einem weiteren Styrolmolekül verbinden. Genau wie bei der
vorherigen Reaktion spaltet sich ein Elektronenpaar der Doppelbindung und bildet zum einen eine
neue Bindung zu dem Kohlenstoffatom mit dem einzelnen Elektron, zum anderen bildet sich wieder
ein Radikal.
Das um ein Styrolmolekül verlängerte Radikal kann erneut mit einem Styrolmolekül reagieren und auf
diese Art und Weise kommt es zum Aufbau eines Polymers aus Styrol, dem Polystyrol.
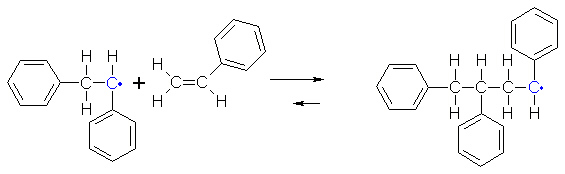
Solange Monomere vorhanden sind, werden diese zu Polymeren verbunden. Die Reaktion hört auf, wenn alle Monomere verbraucht sind, oder wenn zwei Radikale aufeinandertreffen. Denn dann bilden die zwei einzelnen Elektronen ein Bindungselektronenpaar, und die Reaktionskette bricht ab.
Anionische Polymerisation
Diese Reaktion soll anhand des Cyanoacrylats ("Acrylnitril"), das die klebende Kraft im Sekundenkleber
ist, erklärt werden.
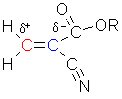
Für R können verschiedene Gruppen wie Methyl- oder Ethylgruppe eingesetzt werden.
Die Elektronenpaare der Doppelbindung werden von den beiden Kohlenstoffatomen unterschiedlich stark angezogen. Das blau gekennzeichnete Kohlenstoffatom zieht die Elektronen viel stärker an als das rote. Der Grund liegt in den Ester- und Nitrilresten, die einen starken (-I)-Effekt besitzen. Dadurch kommt es zu einer Polarisation der Doppelbindung. Dies haben wir in der o. a. Struktur schon eingezeichnet.
Wenn sich dem positiv polarisierten "roten" Kohlenstoffatom ein Nukleophil wie ein Wassermolekül nähert,
dann kommt es zu einer Bindung, bei der der Sauerstoff das bindende Elektronenpaar zur Verfügung stellt.
Er bekommt dadurch innerhalb des Moleküls eine positive Ladung.
Simultan klappt das Elektronenpaar der Doppelbindung zum "blauen" Kohlenstoffatom, das dadurch eine
negative Ladung bekommt.
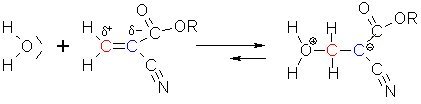
Durch diese negative Ladung kann jetzt mit einem anderen Cyanoacrylatmolekül nach dem gleichen Schema eine Verbindung ausgebildet werden.
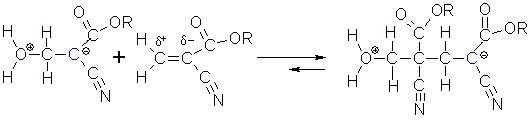
Auf diese Weise wird die negative Ladung längs der Kette nach vorn verschoben.
Nach Beendigung der Polymerisationsreaktion sind die Polymerketten an einem Ende positiv und am anderen
Ende negativ geladen. Durch eindiffundierendes Wasser werden diese Ladungen mit der Zeit durch Bildung von
OH-Gruppen "neutralisiert".
Kationische Polymerisation
Diese Reaktion soll anhand der Polymerisation von Styrol dargestellt werden. Als startendes Kation
lagert sich ein Proton (z. B. von Schwefelsäure) an das rot gekennzeichnete Kohlenstoffatom an. Da zur
Bindung des Protons ein Elektronenpaar benötigt wird, "klappt" ein Elektronenpaar der Doppelbindung des
Styrols zum H+-Ion und verbindet dieses mit dem roten Kohlenstoffatom. Am "blauen"
Kohlenstoffatom fehlt jetzt ein Elektron, es ist daher positiv geladen.
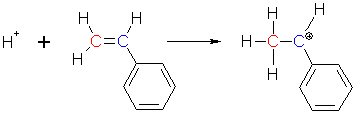
Warum dockt das Proton nicht am "blauen" C-Atom an? Das hat vor allem sterische Gründe: Der riesige Phenylrest verdeckt die Bindungsstellen.
Dieses so entstandene Kation-Molekül bindet an ein Styrolmolekül. Genauso wie das H+-Ion kann das positiv geladene, blaue Kohlenstoffatom das Elektronenpaar der Doppelbindung an sich ziehen und eine Bindung zwischen sich und dem grünen Kohlenstoffatom aufbauen. Da jetzt dem grauen Kohlenstoffatom ein Elektron aus der Doppelbindung fehlt, trägt es eine positive Ladung. Weil die positive Ladung immer wieder an das Ende der entstehenden Kette "weitergereicht" wird, können dort auch immer wieder Styrolmoleküle gebunden werden.
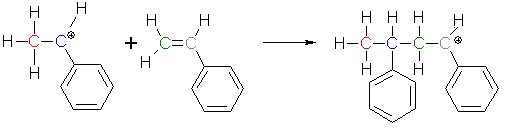
Die Polymerisation schreitet solange vorwärts, bis entweder die Monomere verbraucht sind, oder das positiv geladene Ende eines Polymers auf ein negatives Ion trifft, z. B. das HSO4--Ion, das bei der Dissoziation der Schwefelsäure entstanden ist.
Weiteres zu den Kunststoffen findet man hier.
Weitere Texte zum Thema „Kohlenwasserstoffe“