 |
| Bild 1: Iodat-Uhr (Foto: Daggi)
Hierzu gibt es einen Film (5 MB) Klicke hier |
Oszillierende Reaktionen: Am Anfang stand die Citronensäure
Experimente:
Versuch: Oszillierende Reaktion der Citronensäure
Versuch: Oszillierende Reaktion der Malonsäure mit Bromat und Cer
Versuch: Oszillierende Reaktion der Malonsäure mit Iodat und Mangan
Versuch: Die oszillierende Reaktion des Ascorbinsäure/Cer/Bromat-Systems
Versuch: Oszillierende Reaktion des Oxalsäure/Cer/Bromat-Systems
 |
| Bild 1: Iodat-Uhr (Foto: Daggi)
Hierzu gibt es einen Film (5 MB) Klicke hier |
Von großer Bedeutung für die chemische Forschung sind die oszillierenden oder periodischen
Reaktionen. Einige waren schon vorher bekannt. Die heute diskutierten Reaktionen mit organischen
Verbindungen entdeckte 1958 der russische Chemiker B. Belousov. Er befasste sich mit der
Bromierung von Citronensäure. Dazu setzte er Kaliumbromat in schwefelsaurer Lösung ein.
Als Katalysator diente Cersulfat. Beim Verfolgen der Reaktion beobachtete er, dass die
Reaktionsmischung ständig ihre Farbe zwischen Farblos/Weiß und Dunkelgelb wechselte.
Außerdem schwankt analog zu den Farben das Redox-Potential (-> Versuch). Die
erste leicht reproduzierbare oszillierende Reaktion war entdeckt. Der Physikochemiker A. M.
Zhabotinskii befasste sich mit den ersten Versuchen zur Erklärung dieses Phänomens. Heute
spricht man von Belousov-Zhabotinskii-Reaktionen.
In der Schule kennt man vor allem die Reaktionsmischung mit Malonsäure anstelle von
Citronensäure. Zur Verfolgung der Redox-Lage gibt man gern den Redox-Indikator Ferroin zu
(-> Versuch).
Bekannt ist auch die Reaktionsmischung aus Kalium-Iodat, Malonsäure, Wasserstoffperoxid,
Perchlorsäure und Mangan (Briggs-Rauscher-Reaktion, -> Versuch).
Oszillationen beobachtet man auch bei der Oxidation von Ascorbinsäure.
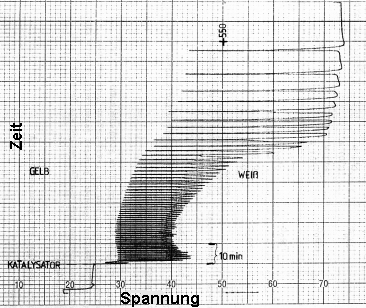 |
| Bild 2 (Quelle: Rita Weßel [23]) |
Was läuft bei oszillierenden Reaktionen ab?
Es handelt sich um die katalytische Oxidation des organischen Substrats. Die Reaktion beginnt
im Allgemeinen mit einer Bromierung. Besonders bei der Malonsäure beobachtet man eine
Decarboxylierung, erkennbar an der starken CO2-Entwicklung. Die Oxidationsmittel sind
Bromat- und Iodat-Ionen sowie Wasserstoffperoxid.
Diese Reaktionssysteme sind ausgesprochen komplex und ihre Abläufe für Außenstehende nur
schwer nachzuvollziehen. Sie bestehen aus ca. 10, sich untereinander stark beeinflussenden
Elementarreaktionen. Eine große Rolle spielen Autokatalysen, die ab einem bestimmten
Konzentrations-Niveau auf andere Reaktionen einwirken. Die Ergebnisse dieser Teilreaktionen
bewirken rückkoppelnd (selbstregulierend) den Start von anderen Reaktionen, wobei
Hemmschwellen wie z. B. eine bestimmte Lage des Redox-Potentials oder die
Konzentrationswerte verschiedener Reaktanden überwunden werden müssen. Das hat die
Periodizität in Farbigkeit und Redox-Spannung zur Folge. Insgesamt befindet sich das
Reaktionssystem weit weg vom Gleichgewichtszustand. Diesen erreicht es erst, wenn die
Konzentration eines Reaktanden nicht mehr für die Überwindung der angesprochenen
Hemmschwellen ausreicht. Dann hört die Oszillation auf.
Oszillierende Reaktionen sind wichtige Modellreaktionen für
biologische Abläufe
Auch biologische Systeme bewegen sich weit weg vom Gleichgewichtszustand. Denn der
Zustand eines offenen Systems, den wir Leben nennen, hat ein sich selbst regulierendes
Fließgleichgewicht und deshalb große Potentialunterschiede zur Voraussetzung. Ohne diesen
Spannungszustand gäbe es kein Leben; der spannungslose Zustand ist der eines toten
Lebewesens. Wir beobachten folglich auch bei biologischen Systemen Oszillationen. Das beginnt
schon auf der Ebene von biochemischen Reaktionsketten (wie der Atmungskette oder der
Glykolyse), setzt sich fort in individuellen Biorhythmen und führt weiter zu großen
Ökosystemen.
Aus diesem Grunde ist das Studium der Belousov-Zhabotinskii-Reaktion wichtig, vor allem
wenn es um die mathematische Modellbildung solcher Systeme geht. Interessant ist, dass diese
Reaktionen in geeigneten Gefäßen auch räumliche Verteilungen zeigen. Diese
Kompartimentierungen sind wichtig zur Simulation größerer biologischer Systeme.
Oszillierende Reaktionen gibt es auch mit anderen Reduktionsmitteln
Beispiele sind die Reaktionen mit Ascorbinsäure und mit
Oxalsäure als Substrate.
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Weitere Texte zum Thema „Zitrone“