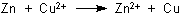
Daniell-Element
Experimente:
Versuch: Daniell-Element
Das Daniell-Element ist ein galvanisches Element, das aus einer Kupfer- und einer Zinkhalbzelle
besteht. In der Kupferhalbzelle befinden sich eine Kupferelektrode und einmolare Kupfersulfatlösung
und in der Zinkhalbzelle eine Zinkelektrode und einmolare Zinksulfatlösung.
Die Strom liefernde Reaktion ist:
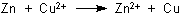
Hier ist die Zeichnung zum Daniell-Element
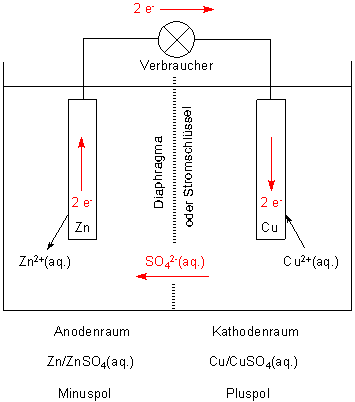
Daniell-Element. Der Strom liefernde Kreislauf ist rot eingezeichnet.
(Zu den Begriffen Anode und Kathode klicke hier.)
Beim Betrieb des Elements laufen folgende Reaktionen ab:
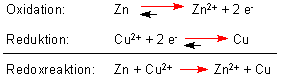
Die Zinkelektrode löst sich also mit der Zeit auf, wobei die Kupferelektrode schwerer wird.
Das Daniell-Element (-> Versuch) liefert eine Spannung von etwa 1,1 Volt.
Was genau geschieht
An der Anode (Zink) gehen positiv geladene Zn-Ionen in Lösung. Die Elektronen wandern zum Pluspol (mit
dem Metall der höheren EN), also an die Kathode (Kupfer). An der entladen sich nun positiv geladene Cu-Ionen.
Im Anoden-Raum sind nun zu viele Zink-Ionen, im Kathoden-Raum zu wenig Kupfer-Ionen. Der Ladungsausgleich erfolgt durch die Sulfat-Ionen, die in den Anoden-Raum fließen.
Insgesamt erfolgt bei Stromschluss ein lawinenartiger Kreisverkehr von negativen Ladungsträgern.
Natürlich werden ein paar Zink-Ionen in den Kathoden-Raum wandern. Dafür sorgen die positive Ladung der Cu-Elektrode und die Diffusion. Aber diese Wanderung wird erschwert durch den beträchtlichen Gegenstrom an Sulfat-Ionen. Man muss sich da ein ziemliches Gedrängel vorstellen - vor allem, weil die Ionen ja noch mit einer voluminösen Hydrat-Hülle umgeben sind, die sie mitschleppen müssen. Zink-Ionen sind deshalb im Kathoden-Raum eher die Ausnahme.
Hinzu kommt, dass die Cu-Elektrode mit einem Pelz von auf die Entladung „wartenden“ Cu-Ionen umgeben ist. Eine Entladung der Zink-Ionen ist deshalb auszuschließen. Außerdem wird wegen des negativen Standardpotentials des Zinks die Entladungsspannung nicht erreicht.
Weitere Texte zum Thema „Elektrochemie“