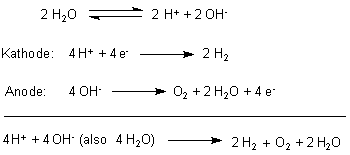
Elektrolyse von Wasser
Experimente:
Versuch: Elektrolyse von verdünnter Schwefelsäure
Versuch: Elektrolyse von wässriger Natriumsulfatlösung
Versuch: Elektrolyse von Wasser mit einfachen Mitteln
Bei der Elektrolyse von Wasser entstehen die Gase Wasserstoff und Sauerstoff im
Volumenverhältnis 2:1.
2 H2O ———> 2 H2 + O2
Jedoch werden die Moleküle des Wassers nicht direkt zerlegt, sondern die durch die Eigendissoziation des Wassers im Gleichgewicht stets vorliegenden H+- und OH--Ionen werden entladen.
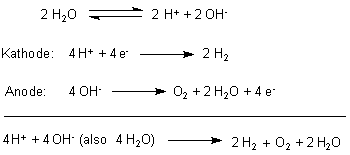
In reinem Wasser sind jedoch so wenig dieser Ionen enthalten, dass man ohne weitere Maßnahmen keine ökonomisch sinnvolle Elektrolyse durchführen kann. Das ist schade, denn die Wasserelektrolyse ist wichtig zur Gewinnung von Wasserstoff und Sauerstoff und wird dort durchgeführt, wo es billigen Strom gibt, also bei Wasserkraftwerken (Assuan-Staudamm in Ägypten) oder Fotovoltaikanlagen. Auch Windkraft ist hier zu nennen.
Zunächst muss man die Leitfähigkeit des Wassers erhöhen. Als Leitelektrolyt kann man nicht ein beliebiges Salz oder irgendeine Säure nehmen. Denn deren Anionen dürfen nicht entladen werden können. Bei Natriumchlorid bzw. der Salzsäure entsteht so zum Beispiel Chlor. Man nimmt Schwefelsäure und Sulfate.
Die Elektrolyse läuft überhaupt nicht so einfach ab, wie man sich das vorstellt. Die
Entladung von Wasserstoff-Ionen ist unproblematisch. Grund für die Komplikationen
ist die sehr hohe Aktivierungsenergie vor allem an der Anode. Man sagt auch, dass
Sauerstoff (anders als Wasserstoff) eine zu hohe Überspannung gegenüber Platin
aufweist und sich deshalb nicht so einfach aus den OH--Ionen des Wassers bildet.
Zunächst kann man die Prozesstemperatur erhöhen. Damit das Wasser dabei nicht
verdampft, erhöht man auch den Druck. So arbeitet man bei über 100 °C.
Die Aktivierungsenergie senkt man bekanntlich mit Katalysatoren.
Das betrifft zunächst einmal das Material, aus dem die
Elektroden gefertigt werden. In Gebrauch sind Elektroden aus Edelmetallen wie
Gold und Platin. Diese werden auch noch besonders fein verteilt.
Es gibt aber noch einen weiteren Effekt, nämlich die Katalyse durch Sulfat-Ionen.
Man hat nämlich festgestellt, dass besonders gut verdünnte Schwefelsäure sowie
Natriumsulfatlösungen elektrolysiert werden können, wobei Wasserstoff und
Sauerstoff entstehen. Dahinter verbirgt sich ein komplizierter Katalysekreislauf, über
den wir gesondert berichten (-> Was läuft bei der Elektrolyse von Schwefelsäure
eigentlich ab?).
Mit Hilfe von Membranverfahren kann man neuerdings auch Reinstwasser elektrolysieren. Elektrolyt ist eine Ionenaustauschermembran. Dieses Verfahren läuft im Prinzip wie eine umgedrehte Brennstoffzelle. Auch über diesen besonders materialschonenden Prozess berichten wir in einer besonderen Webseite.
Weitere Texte zum Thema „Elektrochemie“