Nickel-Metallhydrid-Akkumulatoren
In vielen Geräten des täglichen Gebrauchs wie zum Beispiel in den Handys findet man den Nickel-Metallhydrid-Akkumulator (abgekürzt: NiMH-Akku). Dieser zeigt gegenüber dem früher vorrangig genutzten, ähnlich aufgebauten Ni/Cd-Akku große Vorteile. Er hat zunächst einmal eine größere Energiedichte (65 Wh/kg verglichen mit 50 Wh/kg beim Ni/Cd-Akku). Vor allem ist er frei vom Memory-Effekt, für den der Ni/Cd-Akku berüchtigt ist: Wird ein Ni/Cd-Akkumulator vor dem vollständigen Entladen wieder aufgeladen, liefert er beim nächsten Entladungsvorgang nur noch die in diesem Zustand vorhandene Betriebsspannung. Das ist so, als ob er sich diesen halbentladenen Zustand "gemerkt" hätte. Aus diesem Grunde sollte man Ni/Cd-Akkus immer vollständig entladen - für den täglichen Gebrauch ist das eine nervige Sache!
Zuvor eine Klärung: Was überhaupt ist ein Metallhydrid?
Wenn man bestimmte Metalle, wie zum Beispiel die der Platin- und Eisenreihe, mit Wasserstoff
zusammenbringt, scheinen sie - ohne dass man sonderlich Druck ausüben muss - diesen förmlich
aufzusaugen. Was passiert mit dem Wasserstoff? Hierüber gibt es verschiedene Vorstellungen,
die aber wahrscheinlich nur extreme Zustände ein und desselben Systems beschreiben.
| - | Einmal soll es sich um eine echte Verbindung zwischen Wasserstoff und Metallen handeln, bei der Wasserstoff die Oxidationszahl (-I) hat. Das Elektron holt sich der Wasserstoff aus dem Metallgitter. |
| - | Andere Autoren beschreiben Metallhydride als Lösungen von Wasserstoff in den Metallen, also quasi als Metall-Wasserstofflegierung. Dann liegt atomarer Wasserstoff im Metallgitter eingebaut vor. Dabei kann in einem Metallhydrid aufgrund der engen Packung sehr viel Wasserstoff gespeichert werden. Das Volumen dieses Speichers ist deshalb geringer als das Volumen, welches die gleiche Wasserstoff-Menge in verflüssigter Form einnehmen würde. Darauf beruhen Metallhydridspeicher, die zum Beispiel in der Brennstoffzellentechnologie Anwendung finden. |
Je kleiner die Elektronegativität der Metalle ist, desto eher bilden sie salzartige Hydride. So reagiert geschmolzenes Lithium wie folgt mit Wasserstoff:
2 Li + H2 ———> 2 LiH + Energie
Die Hydride der Alkalimetalle und Erdalkalimetalle sind salzartig aufgebaut. Das bekannteste ist das Lithiumhydrid, das aus Li+-Ionen und Hydrid-Ionen H- besteht. Es bildet sogar ein Gitter, das dem NaCl-Gitter gleicht. In der organischen Chemie wird das Lithium-aluminium-hydrid Li[AlH4] als Reduktionsmittel verwendet. Calciumhydrid (mit dem Gitter von Calciumfluorid) ist ein wichtiges Reduktionsmittel zur Herstellung von schwerschmelzbaren Metallen.
Die Metalle der d- oder f-Reihen ("Übergangsmetalle") bilden dagegen eher legierungsartige Hydride, die allerdings Halbleitereigenschaften haben. Um diese geht es bei den Ni-MH-Akkus. So ist eine dafür geeignete wasserstoffbindende Legierung lt. Wikipedia La0.8Nd0.2Ni2.5Co2.4Si0.1.
Eigentlich sollte man im Zusammenhang mit den Ni-MH-Akkus gar nicht von "Metallhydriden" sprechen. Aber es hat sich nun einmal so eingebürgert.
Aufbau und elektrochemische Abläufe im NiMH-Akku
Vergleichen wir ihn mit einem Ni/Cd-Akku:
Der NiMH-Akku hat etwa dieselbe Zellenspannung von 1,2-1,3 V. Sein Pluspol besteht im aufgeladenen Zustand ebenfalls aus Nickel, das mit Nickel(III)-oxid-hydroxid überzogen ist. Sein Minuspol besteht hingegen nicht aus mit einer Cadmiumhydroxid überzogenen Cadmiumelektrode, sondern aus einer kompliziert zusammengesetzten Metalllegierung (abgekürzt M), in deren Gitter Wasserstoffteilchen (egal, in welcher Form...) eingelagert sind. Elektrolyt ist ebenfalls eine alkalische Lösung, meist Kalilauge.
Der Entladungsprozess sieht so aus, wenn wir uns für die Metall-Wasserstofflegierung entscheiden:
Minuspol (Anode, Oxidation von H) MH + OH- ———> M + H2O + e-
Pluspol (Kathode, Reduktion von Ni(III)) NiO(OH) + H2O + e- ———> Ni(OH)2 + OH-
Gesamtreaktion MH + NiO(OH) ———> M + Ni(OH)2
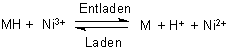
Beim Laden laufen die Reaktionen rückwärts. Kurz gefasst ist der ganze Prozess:

Weitere Texte zum Thema „Elektrochemie“