Kaltes Licht (Luminol-Reaktion)
Experimente:
Versuch: Kaltes Licht - Luminol
Versuch: Chemolumineszenz
Versuch: Blutnachweis mit Luminol
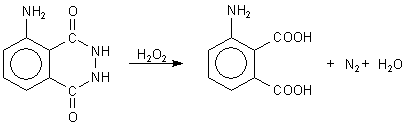
Ein Beispiel für einen Oxidationsprozess, bei dem keine Wärmeenergie, sondern nur Licht freigesetzt wird, ist die bekannte Luminol-Reaktion. Die Reaktion beruht auf der katalytischen Freisetzung von Stickstoff aus dem Phthalsäurehydrazid ("Luminol"). Die formale Reaktionsgleichung ist:

Als Katalysator dient Rotes Blutlaugensalz (-> Versuch). Der Versuchsablauf hängt von der langsamen Freigabe des Katalysators ab. Deshalb ist das käufliche Kristallpulver schlecht geeignet: Es löst sich zu schnell. Besser ist es deshalb, einen dicken Kristall hineinwerfen. Woher aber bekommen wir große Kristalle von Rotem Blutlaugensalz? Die können wir züchten. Hier ist die Vorschrift. Wichtig: Zum Herstellen einer gesättigten Lösung von Rotem Blutlaugensalz darf man die Lösungen nicht erhitzen!
Anstelle von Wasserstoffperoxid können als Oxidationsmittel auch Ozon (-> Versuch) oder Chlor (letzteres zum Beispiel in alkalischer Lösung) verwendet werden.
Der Name "Luminol" kommt daher, dass man solche Lichterscheinungen Lumineszenz nennt (hier: Chemolumineszenz).
Luminol wird zur Herstellung von Kaltlichtfackeln, die man in Camping- oder Trecking-Geschäften kaufen kann, genutzt. Man kann noch weitere Farbstoffe hinzugeben, die das bläuliche Luminol-Licht in andersfarbiges Licht umwandeln (Fluoreszenz).
Mit Luminol kann man Blut nachweisen
Eine überraschende Verwendung findet die Luminol-Reaktion in der forensischen Chemie. Das ist ein
Zweig der Chemie, der sich mit der Aufklärung von Verbrechen befasst. Die
Luminol-Reaktion dient als Blutnachweis (-> Versuch). Dahinter steckt,
dass man als Katalysator auch Hämoglobin oder Katalase nehmen kann. Das sind zwei Proteine, die in
ihrem aktiven Zentrum bekanntlich Eisenkomplexe (Porphyrine) tragen. Diese sind so ähnlich aufgebaut
wie das Rote Blutlaugensalz (Hexacyanoferrat(III)).
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Weitere Texte zum Thema „Energie und Chemie“