
Aufklärung der Struktur des Essigsäuremoleküls
Experimente:
Versuch: Die Verbrennungsprodukte der Essigsäure
Versuch: Iodoformprobe
Versuch: Wie viele Protonen setzt ein Essigsäuremolekül frei?
Die Elementarzusammensetzung
Wenn wir Essigsäure verbrennen, erhalten wir als Verbrennungsprodukte Kohlenstoffdioxid bzw. Ruß sowie
Wasser (-> Versuch). Essigsäure ist also eine Kohlenwasserstoffverbindung.
Genaue Analysen zeigen, dass das Molekül auch noch gebundenen Sauerstoff enthält.
Die Elementaranalyse ergibt
| Masseprozent | Atommasse | Quotient % / M | |
| Kohlenstoff | 39,80 % | 12 | 3,32 |
| Wasserstoff | 6,85 % | 1,008 | 6,8 |
| Sauerstoff | 53,34 % | 16 | 3,33 |
Die Ermittlung der chemischen Formel
Hierzu werden die Quotienten in der obigen Tabelle verglichen:
C : H : O = 3,32 : 6,8 : 3,33 » 1 : 2 : 1
Die einfachste Formel wäre demnach
CH2O
Als 1814 Berzelius die erste Formel der Essigsäure aufstellte, war dies tatsächlich seine Annahme.
Die Formel kann aber noch ein Vielfaches davon sein, zum Beispiel C2H4O2.
Wir benötigen also ein Verfahren, um die Molmasse der Essigsäure zu bestimmen. Dazu verdampft man in einem Volumen Essigsäure und bestimmt die Dichte des Dampfes. Daraus kann man mit Hilfe der Avogadrozahl die Molmasse bestimmen. Sie liegt bei 60 g / mol. Das spricht also für die Formel
C2H4O2
Mit Hilfe der Gefrierpunktserniedrigung hat man ebenfalls die Möglichkeit, die Molmasse zu bestimmen. Da man dazu aber unpolare Lösemittel wie zum Beispiel Benzol nimmt, in denen die Essigsäuremoleküle als Dimere vorliegen, bekommt man als Formel C4H8O4. Auch diese Formel begegnet einem hier und da, wie zum Beispiel in einem alten französischen Schulbuch von 1875.
Die Struktur der Essigsäuremoleküle
Die einfache Iodoformprobe (-> Versuch) sollte genaueren Einblick in die
Struktur der Moleküle geben. Sie hat zur Voraussetzung, dass eine aktivierte Methylgruppe vorhanden ist. Beispiele für
solche Moleküle sind Ethanol, Acetaldehyd und Aceton.
CH3-CH2OH CH3-CHO CH3-CO-CH3
Es bildet sich bei dieser Probe das nach Krankenhaus duftende, weißgelbe feste Iodoform CHI3.
Mit Essigsäure oder Acetat verläuft die Reaktion leider nicht eindeutig, so dass wir sie nicht empfehlen wollen. Die Lösung wird nur gelb, und man stellt nur ab zu den typischen Geruch fest. Dabei sollte man beachten, dass Iodoform wie Chloroform Nerven betäubt und den Geruchssinn stört. Deshalb darf man vorher keine Geruchsprobe mit hochkonzentriertem Iodoform machen, wenn man Spuren schnuppern will!
Trotzdem halten wir fest: Auch die Essigsäure trägt eine Methylgruppe.
CH3-COOH

(Foto: Blume)
Welche Wasserstoffatome gibt Essigsäure als Protonen ab?
Hierzu kommen zwei Möglichkeiten in Frage: Drei Wasserstoffatome befinden sich in der Methylgruppe, eines in der
Carboxylgruppe.
Zur Klärung trägt eine einfache Titration bei (-> Versuch). Da ein Mol Natronlauge
mit einem Mol Essigsäure reagiert, ist nur folgende Möglichkeit richtig: Essigsäure ist eine einbasige Säure.
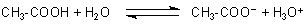
Weitere Texte zum Thema „Essig“