 |
 |
Essigsaure Tonerde ist Aluminiumacetat
Experimente:
Versuch: Untersuchung von essigsaurer Tonerde (Aluminiumacetat)
Das Aluminiumsalz der Essigsäure hat die Formel
(CH3-COO)3Al
Es gibt auch ein basisches Salz:
(CH3-COO)2(OH)Al
Die Anwendungen von Aluminiumacetat sind vielfältig. So ist es zum Beispiel neben Alaun ein wichtiges Beizmittel in der Färbetechnik.
Am bekanntesten ist aber die Essigsaure Tonerde. Das ist eigentlich nichts anderes als basisches Aluminiumacetat. Das ist relativ schlecht löslich. Die Substanz ist in Apotheken auch als filtrierte Lösung erhältlich. Dabei handelt es sich um eine klare, nach Essigsäure riechende Flüssigkeit. Der Name beschreibt, wie man die Substanz herstellen kann: Man behandelt Aluminiumoxid (alte Bezeichnung: Tonerde) mit Essigsäure. Wir sollten die überall käufliche essigsaure Tonerde chemisch untersuchen (-> Versuch).
 |
 |
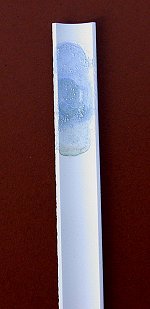
Bild 1: Nachweise von Aluminium in essigsaurer Tonerde (-> Versuch)
(Links: Thénards Blau. Rechts: Komplex mit Alizarin S)
(Linkes Glas ohne Aluminium, die anderen Gläser mit Aluminium)
(Fotos: Daggi)
Essigsaure Tonerde ist ein klassisches Heilmittel. Es vereinigt all das Gute, was man dem Essig nachsagt,
mit der Wirkung von Aluminium-Ionen. Letztere wirken nämlich antibakteriell. Beides zusammen soll
entzündungshemmend sein. Deshalb wird essigsaure Tonerde auch heute noch gern in der
Medizin genutzt.

Bild 2 (Foto: Daggi)
Manche Zubereitungen der Essigsauren Tonerde enthalten noch Tartrat, das Anion der Weinsäure. Der Grund
ist, dass Aluminium-Ionen in wässrigen Lösungen als amphotere Aqua-hydroxy-komplexe
vorliegen, die im neutralen Milieu ungeladen sind und deshalb leicht ausflocken. Dann sind sie aber nicht mehr
antibakteriell wirksam. Deshalb hält man sie (wie die Kupfer-Ionen bei den Fehling-Lösungen) durch
Chelatbildung in Lösung.
Warum reagiert Aluminiumacetat sauer?
Das Salz ist formal das Produkt aus der Reaktion zwischen einer schwachen Base (Aluminiumhydroxid
Al(OH)3) und einer schwachen Säure (Essigsäure CH3-COOH). Hier haben wir anscheinend
die gleichen Verhältnisse wie beim Ammoniumacetat. Letzteres reagiert aber
neutral! Aluminiumacetat dagegen reagiert in wässriger Lösung sauer.
Beim Lösen sind Reaktionen mit dem Wasser denkbar. Wir schreiben das Ganze vereinfacht (ohne die Komplexverbindungen des Aluminiums zu berücksichtigen) so:
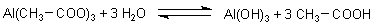
Wir sehen, dass bei dieser Protolyse-Reaktion Essigsäure entsteht.
Wir können aber auch ganz anders argumentieren. Erinnern wir uns: Der resultierende pH-Wert beim Lösen hängt von den pKa-Werten der beteiligten Säure/Base-Systeme ab. Brönsted lehrt uns:
Wenn die Base (hier Al(OH)3) wesentlich schwächer ist als die Säure (hier CH3-COOH), so ist das Anion der Säure (CH3-COO-) weniger basisch als das Kation der Base (hier Al3+) sauer ist.
In diesem Zusammenhang sei daran erinnert, dass Aluminium-Ionen zu den so genannten aprotischen Säuren zählen.
Weitere Texte zum Thema „Essig“