Experimente:
Versuchsgruppe: Silber-Ionen sind Oxidationsmittel
Versuch: Reaktion von Silber mit Salpetersäure
Versuch: Das Bleichen - Oxidation durch Rotes Blutlaugensalz
Versuch: Die Lichtempfindlichkeit von Silbernitrat
Versuch: Das Fällen der Silberhalogenide
Versuch: Die Lichtempfindlichkeit der Silberhalogenide
Versuch: Silberhalogenide lösen sich unter Komplexbildung
Versuch: Silberhalogenide werden durch Natriumthiosulfat löslich
Das Silber gehört zur Gruppe der Edelmetalle. Es ist gegen
die meisten äußeren Einflüsse sehr beständig. Sein chemisches Symbol
Ag geht auf das lateinische Wort "argentum"
zurück.
Es kommt in der Natur gediegen und vor allem in Form sulfidischer Erze vor, von denen der Silberglanz (Formel: Ag2S) wohl das bekannteste ist. Typisch für das gediegene Silber ist, dass man es in Form längerer Fäden findet.
Die Silber-Erze treten fast immer in Gesellschaft von Blei-, Kupfer- oder Zink-Erzen auf, so dass Silber bei der Gewinnung dieser Metalle als Nebenprodukt anfällt.
Die Eigenschaften des Silbers
Farbe: saubere Oberfläche weißglänzend, meist jedoch angelaufen gelblichbraun
Schmelzpunkt: 961,9 °C; Siedepunkt: 2215 °C
Es leitet unter allen Metallen am besten die Wärme und den elektrischen Strom.
Es ist weich und dehnbar.
Das Metall zersetzt sich in Salpetersäure ("Scheidewasser") (-> Versuch).
3 Ag + HNO3 + 3 H+ ———> 3 Ag+ + NO + 2 H2O
Feinverteiltes Silber wird durch Rotes Blutlaugensalz oxidiert (-> Versuch).
Ag + [Fe(CN)6]3- ———> Ag+ + [Fe(CN)6]4-
Seine Verbindungen sind in höheren Konzentrationen keimtötend.
Alle Silberverbindungen sind lichtempfindlich (-> Versuch, -> Versuch).
2 AgCl + Lichtenergie ———> 2 Ag + Cl2
Bis auf Silberfluorid sind seine Halogenide schwerlöslich (-> Versuch).
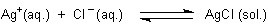
Silber-Ionen sind Oxidationsmittel und deshalb (auch durch organische Substanzen wie reduzierende Zucker) leicht reduzierbar (-> Versuchsgruppe).

Silberhalogenide sind durch Komplexbildner (wie z. B. Ammoniak oder Thiosulfat) in Lösung zu bringen (-> Versuch, -> Versuch).
AgBr + 2 NH3 ———> [Ag(NH3)2]+ + Br-

Bild 1: Belichtetes und unbelichtetes Silberchlorid
(Foto: Daggi)
Alle diese Eigenschaften machen das Silber für den Menschen unentbehrlich.
Es dient aber keinesfalls nur der Herstellung von Münzen und Schmuck! Im Mittelpunkt seiner Verwendung befand sich neben der Elektrotechnik früher vor allem die Fotografie. Daneben stand Silbernitrat unter der Bezeichnung Höllenstein als Desinfektionsmittel bei Medizinern in hohem Ansehen.
Allerdings ist Silber gar nicht so edel, wie du denkst! Du kennst sicherlich dunkel angelaufenes Silber, das deine Mutter ab und zu putzen muss. Silber verbindet sich nämlich liebend gern mit Schwefel, dessen Verbindungen (wie z. B. Schwefelwasserstoff H2S) in Spuren in der Luft vorhanden sind. Dabei entsteht schwarzes Silbersulfid, das Silbergegenstände mit der Zeit unansehnlich macht. Das ist eine recht komplizierte chemische Reaktion, an der Sauerstoff als Oxidationsmittel beteiligt ist.

Bild 2: Angelaufener Silberlöffel
(Foto: Blume)
Die chemischen Abläufe der Sulfidbildung erklären wir im Tipp des Monats Nr. 97. Dort lernt man
auch, wie man angelaufenes Silber reinigt.