Prof. Blumes Tipp des Monats Juli 2005 (Tipp-Nr. 97)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wie funktioniert das Reinigen von angelaufenem Silber?

Bild 1: Angelaufenes Silberbesteck (Foto: Daggi)
Um Silber zu reinigen, wurden ganze Generationen von Hausfrauen und Dienstmädchen
verschlissen. Die Arbeit war nicht nur anstrengend, sondern wegen der geringen
Nachhaltigkeit auch deprimierend. Weiß doch jeder, wie sinnlos das Silberputzen
erscheint: Egal, wie gut und wie oft man das Silber putzt - nach kurzer Zeit ist
es wieder angelaufen. Dabei soll Silber als Metall doch so edel sein!
Das stimmt nur bedingt: Wenn man angelaufenes Silber erhitzt, wird es zwar blank - das weist auf edlen Metallcharakter. Wenn man mit einem Silberlöffel ein Ei isst oder zu lange in der Erbensuppe herumrührt, läuft das Metall augenblicklich wieder dunkel an.
Was passiert beim Anlaufen des Silbers?
Immer, wenn Silber in Gegenwart von Sauerstoff (oder anderer Oxidationsmittel) mit
Schwefelwasserstoff in Kontakt kommt, gibt es den unschönen Überzug.
|
Versuch 1: Wie Silber anläuft
|
Betrachten wir die Reaktion. Zur Erinnerung: Oxidation ist mehr als nur die Reaktion mit Sauerstoff. Sie bedeutet Elektronenabgabe und Überführung in den ionischen Zustand.
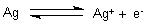
Das Redox-Gleichgewicht liegt stark auf der linken Seite. Silber hat somit ein hohes Redoxpotential und sollte gegen die Oxidation durch Sauerstoff stabil sein.
Wenn jedoch ein Stoff anwesend ist, der wie Schwefelwasserstoff H2S mit Silber-Ionen schwerlösliche Verbindungen eingeht, so wird es auch durch Sauerstoff oxidiert. Grund: Die Bildung der Sulfide setzt Energie frei. Diese wirkt sich negativ auf das Redoxpotential des Silbers aus. Es sinkt von 0,8 Volt auf etwa 0,1 Volt. Das Silber wird dadurch scheinbar unedler.
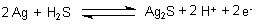
Wer dazu Genaueres wissen will, liest hierzu die Antwort auf Frage 403 und die Foto-Webseite.
Wie können wir Silber reinigen?
Die mechanische Reinigung, also das
klassische Silberputzen mit Putztuch, Schlämmkreide oder ATA, gehört der Vergangenheit
an. Das ist besonders dann der Fall, wenn die zu putzenden Stücke nur versilbert sind
(100er Silber; die Zahl 100 beschreibt den Feingehalt des Silberüberzugs in Prozent).
Der weiche Belag ist bald abgerieben.
|
Versuch 2: Mechanische Reinigung von Silber
|
Das Erhitzen angelaufenen Silbers funktioniert
zwar recht gut - aber nur bei reinem Silber. Es wird dadurch blitzblank. Erhitzt man
dagegen legiertes Silber, wird es meistens erst recht schwarz - wenn zum Beispiel Kupfer
zugemischt wurde, bildet sich schwarzes Kupfer(II)-oxid. Das erlebt man zum Beispiel mit
800er Silber. (Die Zahl 800 beziffert hier den Feingehalt des Silbers in Promille.) Diese
Überzüge sind nicht mehr einfach zu beseitigen. Schließlich ist beim Erhitzen ein Teil des
Löffels verbrannt.
Außerdem kann man viele feine oder sehr große Gegenstände aus Silber nicht ohne weiteres
erhitzen - denn der Schmelzpunkt von Silber liegt bei 961 °C, ist also vergleichsweise
sehr niedrig.
|
Versuch 3: Erhitzen von angelaufenem Silber
|
Ag2S ———> 2 Ag + S
(Zum Erhitzen von Silbersulfid lies Versuch 5 im Tipp Januar 2003.)

Bild 2: Erhitzen eines angelaufenen Silberblechs
(Foto: Daggi)
Reinigen in einem Silbertauchbad
Zum Reinigen von angelaufenem Silber werden Tauchbäder angeboten. Das probieren wir einmal aus.
Gefahrenbelehrung: Silbertauchbäder enthalten Thioharnstoff. Diese (Xn,N)-Substanz steht im Verdacht, krebserzeugend und fruchtschädigend zu sein. Deshalb Einatmen des Staubs vermeiden, beim Hantieren (auch mit Lösungen) wasserdichte Handschuhe tragen!
|
Versuch 4: Demonstration eines Tauchbads zur Silberreinigung
Ergebnisse:
|
Der Gehalt an Thioharnstoff liegt zwischen 5 und 15 %. Außerdem setzt man den Tauchbädern noch
nichtionische Tenside (< 5 %) zu. Das Ganze wird durch eine Säure abgerundet.
Der eigentlich wirksame Inhaltsstoff ist Thioharnstoff. Er bildet mit Silber-Ionen wasserlösliche
Komplexe.
Ag2S (schwerlöslich) + Thioharnstoff- + 2 H+ ———> 2 [Ag(Thioharnstoff)]+ (löslich) + H2S
Er ist somit in der Lage, die Verbindungen, die das Silber anlaufen lassen, wasserlöslich zu machen. Das scheint widersinnig zu sein: Man will schwefelhaltige Überzüge vom Silber herunterbekommen und lässt dazu eine Schwefelverbindung einwirken. Da Thioharnstoff jedoch recht stabil ist, gibt er selbst kaum Schwefel ab. Durch das saure Milieu wird außerdem der Schwefelwasserstoff ausgetrieben. Das Silber läuft deshalb in dieser Lösung nicht wieder an.
|
Versuch 5: Das selbst hergestellte Silbertauchbad (Lehrerversuch)
Ergebnis:
Entsorgung:
|
Bild 3: Unser Tauchbad mit einem halb gereinigtem angelaufenem Silbergegenstand
(Foto: Daggi)
Reinigen mit Alu-Folie
In letzter Zeit wird immer wieder das Reinigen von Silbergegenständen mit Aluminium in
Salzlösung beschrieben. Versuchen wir es einmal.
Die folgende Versuchsvorschrift hat uns Peter Ochs aus Kassel mitgeteilt:
|
Versuch 6: Silberreinigen mit Aluminiumfolie
Ergebnisse:
Hinweis:
|

Bild 4: Silberlöffel in Kochsalzlösung
(Foto: Daggi)
Mit dem folgenden Versuch können wir etwas über die chemischen Vorgänge aussagen.
|
Versuch 7: Nachweis von Schwefelwasserstoff
Ergebnis:
|

Bild 5 (Foto: Daggi)
Was steckt hinter dieser Reinigungsmethode?
Silber und Aluminium bilden ein elektrochemisches (galvanisches) Kurzschluss-Element.
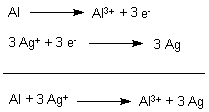
Bei Kontakt von einem edlen und einem unedlen Metall sprechen wir auch von einem Lokalelement. Das Aluminium zersetzt sich dabei. Den Vorgang bezeichnen wir als Korrosion. Dass hierbei ein Strom zwischen Aluminium und Silber fließt, können wir in einem Versuch zeigen.
|
Versuch 8: Galvanisches Element aus Al und Ag
Die Spannung beträgt ca. 0,6 bis 0,8 Volt. Die Stromstärke hängt unter anderem auch von der Größe der Oberflächen der Bleche ab, liegt aber im Milli-Ampere-Bereich. Ob der Prüfmotor läuft, ist ebenfalls eine Frage der Größe der Elektrodenoberfläche. |
Es stellt sich die Frage, warum die gemessene Spannung zwischen dem edlen Silber und dem unedlen Aluminium so niedrig ist. Schauen wir in eine Tabelle mit Standardpotentialen, so sollten wir etwa 2 Volt erwarten. Zunächst einmal ist Aluminium passiviert, täuscht also edleren Charakter vor. Hinzu kommt, dass sich Silber in einer Chloridlösung sofort mit Silberchlorid überzieht. Das Potential einer solchen Silber/Silberchlorid-Elektrode liegt statt bei 799 mV bei 198 mV.
Nun können wir auch erklären, warum wir beim Silberreinigen mit Aluminium Schwefelwasserstoff riechen.
Am Silber bildet sich nämlich darüber hinaus noch Wasserstoff. Das kennen wir vom
Volta-Element.
2 H+ + 2 e- ———> 2 [H]
Dieser Wasserstoff "in statu nascendi" reagiert ebenfalls mit dem Silbersulfid.
Ag2S + 2 [H] ———> 2 Ag + H2S
Analoges gilt für Überzüge von braunem Silberoxid, wobei sich Wasser bildet.
Ag2O + 2 [H] ———> 2 Ag + H2O
(Hiermit lässt sich erklären, wie sich der Zusatz von Säure zum NaCl-Bad in Versuch 6 auswirkt: Dadurch wird die Konzentration der Protonen erhöht, und es bildet sich mehr Wasserstoff „in statu nascendi“.)
Der Vorteil dieser elektrochemischen Methode ist, dass anders als beim mechanischen Putzen kein Silber verloren geht. Hier wird das Silber zurückgebildet.
Die dazu notwendige Korrosion des Aluminiums wird durch Cl--Ionen katalysiert. Hierzu haben wir einen analogen Versuch mit Kupferchlorid in Alu-Becher).
Bei der Reinigung von Silber mit Aluminium ist einiges zu beachten:
| 1. | Die Alu-Folie muss frei von Kunststoffbeschichtung sein. |
| 2. | Bei Ketten sollte jedes Glied Kontakt haben mit der Alu-Folie. Künstlerische Stücke, zusammengesetzt aus verschiedenen Blechen lassen sich nicht völlig reinigen, da der Elektronenfluss an den Phasengrenzen (Lötstellen) gestört sein kann. |
| 3. | Zu lange darf die Silberkette nicht in der Salzlösung liegen, da
sich die Rückbildung des Belags beschleunigt.
Grund: Silber bildet wie alle Metalle im Kontakt mit Wasser (wenn auch als Edelmetall in vergleichsweise geringem Umfang) Silber-Ionen. |
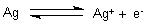
Die haften auf der Oberfläche und bilden mit den im Wasser enthaltenen Chlorid-Ionen spontan eine Schicht von Silber-Chlorid. Da der Niederschlag schwerlöslich ist, bildet sich rasch eine dickere Schicht. Das ist chemisch bereits eine Oxidation! Das Chlorid wird rasch von OH--Ionen sowie von Schwefelverbindungen angegriffen. Dabei bilden sich die bekannten dunklen Silberverbindungen wie AgOH, Ag2O und Ag2S zurück - rascher als vorher.
Im Hellen erweist sich die Silberhalogenidschicht darüber hinaus noch als lichtempfindlich. Es bildet sich feinverteiltes dunkles Silber - das kennen wir als Grundreaktion der Chemie der Fotografie.
Hier setzt im Allgemeinen die Diskussion ein: Salz oder Soda? Beides ist wirksam. Da Chlorid-Ionen katalytisch auf die Zersetzung von Aluminium wirken, ist deren Wirkung etwas größer. Aber auch Carbonat-Ionen bilden wie die Chlorid-Ionen schwerlösliche und lichtempfindliche Silberverbindungen.
Galvanische Elemente auf der Basis von oxidiertem Silber:
Silberoxidbatterien
Auf der Kombination eines unedlen Metalls mit oxidiertem Silber beruht ein galvanisches Element,
das sogar reversibel ist. Es handelt sich um den Zink/Silber-Akkumulator, auch Silberoxidbatterie
genannt. Mit diesem kann man nicht nur zeigen, wie eine Silberoxidschicht entsteht, sondern wie
sie sich auch wieder zurückbildet. Im ersteren Fall muss man elektrolysieren, im zweiten Fall
das System als galvanisches Element laufen lassen. Hierzu haben wir eine Webseite
mit Experiment.
Wenn Sie den Versuch zur Silberoxidbatterie durchführen, werden Sie feststellen, dass der Überzug nicht mehr völlig zurückzubilden ist. Das ist wie im richtigen Leben. Auch mit Alu-Folie ist der Reinigungserfolg nur begrenzt... Grund ist, dass der Überzug nicht durchgehend von Strom durchflossen wird und die Aluminium-Elektronen nicht alle Silber-Ionen in Silbermetall zurück verwandeln können.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 07. April 2011, Dagmar Wiechoczek