 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
781
F: Ich hätte ein paar fragen, die ich für meinen Chemieunterricht für ein
Projekt brauche.
-Woraus besteht Kerzenwachs?
-Und mit was für einem Experiement kann ich die Verbrennungsprodukte von Kerzenwachs nachweisen?
-Außerdem müsste ich drei Flammenschutzmittel kennen, wissen woraus sie bestehen und wie sie wirken.
Da ich schon im Internet recherchiert habe, aber zu keinem guten Ergebniss gekommen bin, wende ich mich an sie
A: Kerzenwachs ist eine Mischung fester Kohlenwasserstoffe (Paraffine).
Zum Nachweis von CO2 und Wasser sowie Ruß in Flammen blicke in unsere Grundschulwebseiten.
Flammschutzmittel gibt es viele. Das sind meist anorganische Salze (Phosphate, Silikate), die zum Beispiel Holz
schützen. Dazu gibt es bestimmte organische Verbindungen (wie Brom- oder Phosphorverbindungen), die beim Schutz
von für elektrische Anlagen genutzten Kunststoffen eine wichtige Rolle spielen.
782
F: Mit Interesse habe ich Ihre Seiten über Milch und insbesondere die
Herstellung von Milchzucker gelesen. Da Milchzucker häufig die Trägersubstanz von Arzneien, insbesondere
Homöopathischen oder Biochemischen würde ich gern wissen, welche Inhaltsstoffe Milchzucker hat. Lagern sich
Rückstände aus der Molke wie z.B. Arzneimittel, Jod, usw. im Milchzucker ab?
Vielen Dank für Ihre Bemühungen.
A: Milchzucker ist zunächst einmal ein Reinstoff.
Man nutzt Zucker und zuckerähnliche Stoffe, um die eigentlichen, im allgemeinen in sehr geringen Mengen
benötigten Wirkstoffe in eine handliche und dazu noch wohlschmeckende Form mit Tablettengröße zu bringen. Dass
ausgerechnet Milchzucker, der von vielen Menschen nicht vertragen wird, als Trägersubstanz in Medikamenten wirken
soll, ist mir nicht geläufig. Wenn Milchzucker dabei ist, soll er in erster Linie laxierend (abführend) wirken,
wie z. B. bei Medikamenten wie Gelusil Lac.
Allerdings bin ich kein Pharmazeut.
783
F: Ich habe Probleme bei 2 für mich sehr schwierigen Redoxgleichungen,
die ich in 2 Tagen der Chemie Klasse vortragen / vorrechnen muss....
Diese wären:
1. SO2 + H2S -> S + H2O
2. H4P2O6 + H2O -> H3PO3 + H3PO3
Könnten Sie mir evtl. die Teilschritte der Oxidation und der Reduktion jeweils angeben?
A: Erst einmal schreiben Sie die beiden Gleichungen richtig:
1. SO2 + 2 H2S ———> 3 S + 2 H2O
Fakt: Schwefeldioxid und Schwefelwasserstoff symproportionieren zu Schwefel.
Red: SO2 + 4 H+ + 4 e- ———> S + 2 H2O
Ox: H2S ———> 2 H+ + S + 2 e- X 2
------------------------------------------------------------------------
Redox: SO2 + 2 H2S ———> 3 S + 2 H2O
2. H4P2O6 + H2O ———> H3PO4 + H3PO3
Fakt: Hypodiphosphorsäure disproportioniert zu Phosphorsäure und Phosphonsäure.
Das kann man eigentlich nur so formulieren. Die römischen Ziffern sind die formalen Oxidationszahlen.
Ox: P(IV) ———> P(V) + e-
Red: P(IV) + e- ———> P(III)
---------------------------------------------------------
Redox: 2 P(IV) ———> P(V) + P(III)
Zur letzten Frage: Wer um Himmels Willen stellt denn solche Aufgaben? Will da jemand seine Schüler von der Chemie abschrecken?
784
F: Wertes Prof.-Blume-Team, könnten Sie mir eventuell die chemischen
Vorgänge beim langsamen Entfärben an der Luft (wahrscheinlich durch Kohlensäure) von mit Phenolphthaleinlösung
angefärbter Natriumhydrogenkarbonatlösung ("Zaubertinte") mit Hilfe der Brönstedschen Säure- und Basendefinition
mitteilen. Irgendwie habe ich da eine Denkblockade. Warum Natriumhydrogenkarbonatlösung basisch reagiert ist mir
klar, aber wie neutralisiert sich das?
F: Auch wenn Sie es schon wissen: Natriumhydrogencarbonatlösungen
reagieren alkalisch, da die darin enthaltenen Hydrogencarbonat-Ionen (Brönsted-Säuren) mit Wasser reagieren.
Wasser wirkt hier als Brönsted-Base.
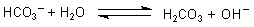
CO2 aus der Luft löst sich im Wasser und bildet Kohlensäure.
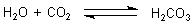
Diese Säure neutralisiert die alkalische Lösung, da sie mit OH--Ionen reagiert. Da das CO2 verbraucht wird, löst sich wieder neues und so weiter... So wird schließlich die Lösung immer neutraler. Ein Indikator färbt sich deshalb entsprechend um.
Man kann aber auch wie folgt argumentieren: Die Bildung der OH--Ionen ist eine Gleichgewichtsreaktion. Das Gleichgewicht wird nach links verschoben, indem man auf der rechten Seite die Konzentration der Kohlensäure erhöht. Dies ist eines der Prinzipien von Le Chatelier. Diese Argumentation gefällt den Chemikern viel besser als die erste...
785
F: Meine frage betrifft sich darauf, wie man Sauerstoff verflüssigt.Welche
Geräte benutzt man? Zu welchen Zwecken wird der verflüssigte Sauerstoff benutzt?Wie ist die Teilchenbewegung?Ich
würde mich auf eine Antwort freuen.
F: Man nutzt dazu einen Lindeapparat. Mit dem gewinnt man zuerst flüssige
Luft. Aus der destilliert man den Stickstoff raus, Sauerstoff bleibt zurück. Ein Vorteil der Gasverflüssigung ist,
dass man es so besser transportieren kann. Dazu braucht man allerdings Hochdruck-stabile Stahlflaschen.
Benötigt wird Sauerstoff zum Schweißen und für andere Oxidationszwecke wie z. B. für die Raumfahrt (Weltraumfähre!).
Auch als Oxidationsmittel in Brennstoffzellen wird er genutzt. Wichtig ist auch die Verwendung in der Notfallmedizin
oder für Taucher.
Die Teilchenbewegung ist wie in einer Flüssigkeit.