 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1301
F: Flecken von Fruchtsaft oder Rotwein soll man sofort mit
Kochsalz bestreuen und dann mit Wasser auswaschen. Was steckt chemisch dahinter?
A: Hierzu haben wir eine Webseite.
1302
F: Betreff: Geldscheine lösen sich auf: Sulfate???
Hallo Herr Blume!
In der momentanen Diskussion über die mysteriöse Selbstauflösung von Geldscheinen wird in
der Presse gemeldet, dass Schwefelsäure auf den Banknoten zu deren Zerfall geführt hätte.
Weiter wird gemutmaßt, dass Sulfate auf die Geldscheine gelangt sind, und diese in
Verbindung mit Körperschweiss zur Bildung der aggressiven Säure geführt hätten.
Nun bin ich mit meiner Säure-Base Chemie am Ende. Wenn wirklich Sulfat-Ionen auf den
Geldscheinen sind, würden diese doch als Brönsted-Base reagieren. Die Entstehung von
Schwefelsäure aus Sulfat-Ionen kann ich mir nicht erklären.
Können Sie mir auf die Sprünge helfen?
Schon mal besten Dank, auch für Ihre Mühe mit den vielen anderen Antworten, die oftmals
sehr interessant zu lesen sind.
Mit freundlichen Grüßen
...
A: Natürlich haben Sie Recht. Das gibt Brönsted
nicht her, weil die Sulfat-Ionen nur gegenüber ausreichend starken Säuren wie HCl oder
Schwefelsäure selbst als Basen reagieren. Vor allem die SPIEGEL-Theorie mit dem Sulfat aus
Amphetaminen, das durch die Säuren im Handschweiß aktiviert wird, ist m. E. Unsinn. Wenn das
so wäre, würde ja das sulfathaltige Rauschgift erst recht im Körper anfangen, stark sauer zu
wirken, z. B. auf den Nasen- oder Mundschleimhäuten! Das würde man sofort merken.
Meine Meinung: Da ist jemand sauer auf den Teuro, auf die Welt und auf sich selbst und
reagiert seinen Frust ab, indem er Geldscheine kurzzeitig mit verdünnter (etwa 30%iger)
Schwefelsäure behandelt, sie dann trocknen lässt und in den Verkehr bringt. Die Schwefelsäure
wirkt langsam, aber effektiv. Der Mann hat im Chemieunterricht gut aufgepasst...
1303
F: Ich habe eine Frage in Bezug auf die Synthese eines
Diisocyanats.
Für die Herstellung von Polyurethan muss man ja einen mehrwertigen Alkohol mit einem Diisocyanat reagieren lassen. Leider haben wir in unserer Schullabor die Diisocyanatkomponente nicht mehr und die Schule hat kein Geld diese zu kaufen.
Jetzt ist meine Frage: Kann man ein Diisocyanat auf verhältnismäßig einfachem Weg ohne besonders giftige Stoffe (z.B. Phosgen bzw. Natriumazid) herstellen? Ich hatte die Idee, zum Beispiel Dichlorbutan (oder ein anderes Dihalogenalkan) mit einem anorganischen Isocyanat-Salz nucleophil zu substituieren. Ist das möglich und wenn ja wie (Lösungsmittel, Temperatur, Katalysatoren)?
In Wasser kann man es ja leider nicht machen, weil sich das Diisocyanat dann zersetzt und wir dann keinen Kunststoff mehr herstellen können.
A: Zu Ihrer Frage: Die Herstellung von Diisocyanaten wird
Ihnen kaum gelingen. Vor allem ist sie mit der Verwendung von extremen Gefahrstoffen verbunden.
Ausgangsstoffe sind reine Diamine (C), die man mit dem Gas Phosgen (T+) reagieren lässt:
H2N-R-NH2 + 2 COCl2 ———> O=C=N-R-N=C=O + 4 HCl
Phosgen werden Sie kaum bekommen. Bophal lässt grüßen... Schließlich wird schon aufgrund der Schutzmaßnahmen und der Entsorgung von Abfällen die Eigensynthese teurer, als wenn Sie die Substanz gleich kaufen.
1304
F: Betr.: Versuch 112: Herstellung von Nitrocellulose
(Cellulosetrinitrat)
Ich mag mich irren, aber ist es nicht am sichersten Cellulosetrinitrat mit Wasser oder Ether anzufeuchten, um es zu lagern, da ansonsten u.U. eine spontane Zersetzung erfolgen kann?
A: Genau genommen dürfen Sie Nitrocellulose überhaupt
nicht lagern, denn das verstößt gegen das Sprengstoffgesetz.
Aber Sie haben mit Ihrem Hinweis trotzdem Recht. Lagern Sie Nitrocellulose leicht mit Wasser
angefeuchtet.
Auf keinen Fall aber sollten Sie zum Anfeuchten Ether nehmen, weil der bei einem Unfall den
Umfang eines möglichen Unglücks noch erhöhen würde...
1305
F: Könnten Sie mir bitte erklären, warum tert-Butanol bei
Raumtemperatur (293 K) ein Feststoff ist?
A: Sie meinen 2-Methyl-propanol-2.
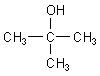
Das tert-Butanol besteht aus Molekülen, die aufgrund ihrer kugeligen Form sehr gut Kristalle bilden
können. Dabei bilden sich abwechselnd Wasserstoffbrücken und van der Waals-Bindungen aus.
Andererseits hat t-Butanol wegen seiner kugeligen Moleküle aufgrund der geringen Kontaktflächen der
Moleküle untereinander auch den niedrigsten Siedepunkt. Die Werte für die isomeren Butanole finden Sie
hier.