 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1451
F: Betreff: Hallo
Hallo Herr Blume,
können Sie mir sagen,welche Energieumwandlung bei allen kohlenstoffhaltigen Brennstoffen erfolgt?
Jasmin
A: Hier geht es wohl um die Oxidation oder Verbrennung von
Kohlenwasserstoffen. Also der Reihe nach:
Im System Sauerstoff/Kohlenwasserstoffe ist zunächst -> chemische Energie enthalten. Bei der Verbrennungsreaktion (eingeleitet durch Zufuhr von -> Aktivierungsenergie, meistens in Form von Wärme, aber auch durch kinetische Energie wie im Dieselmotor) wird diese chemische Energie umgewandelt in -> Wärme (kalorische Energie) und -> Lichtenergie. Die Wärme kann zum Verdampfen von Wasser genutzt werden (-> Verdampfungswärme). Der Wasserdampf nimmt durch das Erhitzen an Volumen zu, bekommt -> Volumenenergie und kann so eine Turbine antreiben (-> kinetische Energie). Diese Turbine kann wie ein Dynamo wirken und kinetische in -> elektrische Energie umwandeln. Die elektrische Energie wird nach Leistung von -> Arbeit letztlich wieder in -> Wärme umgewandelt.
F2: Ich hätte da mal eine Frage: Welche Energieumwandlung findet bei der
Verbrennung bei Benzin im Motor statt?
A2: Chemische Energie, die im Gemisch Sauerstoff/Benzin steckt, wird in Wärme
(kalorische Energie) umgewandelt. Dadurch entstehen heiße Gase, die Volumenarbeit (auch eine Form der Energie) leisten.
Diese wird in kinetische Energie umgewandelt – zunächst die des Kolbens im Zylinder, dann über die Kurbelwelle in die
kinetische Energie des Autos. Ein Teil wird danach auch in elektrische Energie umgewandelt – in der Lichtmaschine. Und
wenn man noch will, wird davon ein Teil in Lichtenergie umgewandelt – beim Strahlen der Lampen.
Hierzu haben wir eine Webseite.
1452
F: Ich habe eine Frage zur Säurestärke der Ethansäure. In einigen Büchern
wird von einer mittelstarken, dann wieder von einer schwachen Säure gesprochen. Wie wird die Ethansäure eingestuft?
Welche Formel ist dementsprechend für die Berechnung des pH-Wertes geeignet?
A: Begrifflichkeiten wie „mittelstark“ haben in der Chemie wenig Sinn.
Stark/Schwach ist ganz anders definiert als im „normalen Leben“. Es geht hier um die Brönstedsche Säure/Base-Theorie.
Starke Säuren liegen in Lösung vollständig dissoziiert vor. Beispiel: Salzsäure:
HCl + Wasser ———> H3O+ + Cl-(aq)
Schwache Säuren (wie die Essigsäure) dagegen sind nur zum Teil dissoziiert. Hier liegt ein chemisches Gleichgewicht vor.
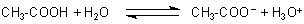
Der Dissoziationsgrad z. B. einer 1molaren Lösung beträgt nur etwa ein Promille. Ob eine schwache Brönsted-Säure „stark“ oder „mittelstark“ bzw. „schwach“ ist, ist eine Frage ihres pKa-Werts (indikator/indi05.htm). Das ist der pH-Wert, bei dem der Dissoziationsgrad 50 % beträgt.
Der pH-Wert von Lösungen schwacher Säuren kann näherungsweise nach folgendem Algorithmus berechnet werden:
pH = ½ (pKs - log c)
Berechnungsbeispiele siehe hier.
1453
F: Betreff: Wie kommt Alkoholgeschmack zustande?
Hallo Herr Prof. Blume,
ich habe leider bisher vergeblich nach der Antwort auf meine Frage gesucht:
Wodurch kommt der Geschmack bzw. das Empfinden im Mund von Ethanol zu stande. Ist dies spezifisch für Ethanol
oder rufen dies auch andere Alkohole wie Methanol etc. hervor, oder sogar andere organische Verbindungen?
Ich hoffe Sie können mir bei dieser Fragestellung helfen. Für Ihre Bemühungen möchte ich mich schon jetzt bedanken.
mfg (…)
A: Hier geht es nicht um Geschmack, sondern um Geruch. Wir haben keinen
Geschmack für Alkohol. Deshalb hat auch jeder Alkohol seinen eigenen Geruch (oder wenn Sie so wollen: Geschmack…).
Dieser Geruch ist eine subjektive Stoffeigenschaft; deshalb riecht jeder Alkohol für verschiedene Leute auch
unterschiedlich. Methanol z. B. riecht für mich eher fischig. Schnuppern Sie mal an Alkoholen der Reihe C1-C5.
Ethanol und Propanol riechen „aromatisch“. Butanol riecht ein wenig wie UHU®. Spätestens beim Pentanol (Amylalkohol)
fallen Sie um… Damit hat man übrigens früher die Permanentschreiber gefüllt. Deren Nutzern ist regelmäßig schlecht
geworden.
Voraussetzung für Geruchsbildung ist, dass der Stoff verdampfen kann. Langkettige Alkohole wie der in natürlichen
Wachsen gebundene Stearylalkohol (C18) sind dagegen geruchlos. Denn sie verdampfen nicht.
F2: Zunächst bedanke ich mich bei Ihnen für ihre bisherige Antwort. Leider
befriedigt diese noch nicht ganz,denn durch was kommt das Gefühl (leichtes Brennen, gefühlte Wärme) im Mund zustande?
mfg (…)
A2: Zu Ihrer Erinnerung: Sie fragten (im Betreff…) zuerst nach dem Geschmack.
Nun also zum „leichten Brennen und der gefühlten Wärme“. Sie merken schon, dass schon allein von der Begrifflichkeit
her beide miteinander etwas zu tun haben.
Alkohol ist ein Zellgift – nicht nur für die Leber! Es wird von den Nerven der Schleimhaut als Störfaktor empfunden.
Wir können ruhig sagen: als Schmerz. Das ist das Brennen, welches wir empfinden. Hinzu kommt, dass Alkohol nicht nur als
Substanz toxisch wirkt, sondern auch ein gutes Lösemittel ist, das vor allem die Membranen der Zellen sowie die isolierenden
Umhüllungen der Nervenzellen angreift.
Das Wärmegefühl kommt daher, dass der Organismus versucht, durch verstärkte Durchblutung den Störfaktor zu beseitigen.
Damit zieht das Blut aus dem Körper in die Peripherie und kühlt stark aus. Wenn also jemand einen Schnaps zum „Aufwärmen“
trinkt, passiert letztlich das Gegenteil: Die Person kühlt aus. Aus diesem Grunde erfrieren Betrunkene eher als Nüchterne.
Das liegt also nicht nur am Beduseltsein.
1454
F: In unserem Garten stehen eine Menge Euphorbia lathyris-Pflanzen (kreuzblättrige
Wolfsmilch). Ich habe einige von ihnen rausgerupft. In der Nacht stellte ich einige starke, schmerzhafte Hautveränderungen
an den Händen und im Gesicht fest. Kann das von der Euphorbia kommen?
A: Ziemlich sicher. Ich kenne das leider auch…

Euphorbia latyris (auch lathyris)
(Foto: Blume)
Offenbar haben Sie die Pflanze nicht nur mit den Händen berührt, sondern sich mit den kontaminierten Händen auch noch ins Gesicht gefasst. Die Pflanze sondert bei Verletzungen einen weißen Saft ab. Der hat es in sich!
Der Ausschlag besteht aus viel Flüssigkeit absondernden Pusteln. Der Arzt nennt das „ödematös“. Charakteristisch sind
die brennenden Schmerzen, wenn man die Stellen berührt. Aber auch ein unangenehmes Prickeln war zu spüren. Im Gesicht
juckte es eher. Ich hatte dazu im Gesicht unter starker Schwellungsbildung zu leiden. Die Haut begann hier in einzelnen
Bereichen Schuppen zu bilden. Im Nasenbereich bildeten sich sogar Krusten schmerzhafte Krusten.
Dies zusammengenommen ist das klassische Krankheitsbild einer „irritativen Kontaktdermatitis ohne immunologischen
Hintergrund“.
Nach einigen Tagen war der Spuk vorbei. Lindernd geholfen hat mir die Hametum®-Creme aus der Apotheke.
Mittlerweile weiß ich, dass auch die Früchte der Euphorbia, die diese Pflanze mit einem leisen Knall in alle Richtungen „verschießt“, sehr giftig sind. Ich habe daraufhin die Pflanze aus meinem Garten verbannt.
Beim Giftstoff handelt es sich um ein kompliziert gebautes C20-Terpen aus der Reihe der Ingenol-Ester. Wieder einmal ein Beispiel dafür, dass nicht alles gut ist, was „Bio“ ist…
Man denkt übrigens darüber nach, diese Euphorbia als Nachwachsenden Rohstoff zur Gewinnung von Biotreibstoff einzusetzen. Dazu muss man aber erst die wegfliegenden Früchte, aus denen man das Öl gewinnen will, bändigen. In der Nachbarschaft einer solchen „Biodiesel“-Produktionsstätte möchte ich allerdings nicht wohnen!
1455
F: Was ist ein kalter Aufschluss?
A: Den kalten Aufschluss gibt es nicht. Das ist ein Schnack aus dem Laboralltag.
Früher mussten die Chemiestudenten Analysen kochen. Die wurden ihnen von Assistenten zusammengemixt. Die Mischung hatte
sich der Assistent in einem Büchlein notiert. Geschickte Leute klauten dem Assistenten das Buch, oder es gelang ihnen,
dem Assistenten bei der Besprechung über die Schulter ins Büchlein zu schauen. Das nannte man „kalten Aufschluss“.
Die anderen, klassischen und meistens heißen Aufschlussverfahren finden Sie hier beschrieben: Kurze Fragen 36.