 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1716
F: Ihr Schülerexperiment Nr.12 zur Kupferraffination mit Geldstücken und Messing-Unterlegscheiben
habe ich schon mal durchführen lassen, es klappt gut.
Was mir schleierhaft ist: woraus besteht denn der "Anodenschlamm"? Im Messing ist doch wohl kein Gold und kein Silber enthalten.
Handelt es sich um Oxide des Eisenkerns der Messingscheibe? Man braucht es den SchülerInnen je nicht auf die Nase zu binden, aber ich
wüsste es selber schon gern.
A: Ihre Frage betrifft diesen Versuch. Im
üblicherweise bekannten Anodenschlamm befindet sich bekanntlich alles, was unter den Bedingungen der Elektrolyse nicht in
Ionenform übergehen kann (also Edleres als Cu). Das ist hier sicherlich nicht der Fall.
Bei der Elektrolyse wird das zu zersetzende Legierungsstück als Anode geschaltet. Das Kupfer soll sich in Kationen umwandeln und dann zur Kathode wandern, wo es als reines Metall abgeschieden wird.
Anode:
Cu -> e- + Cu+
Cu -> 2 e- + Cu2+
An der Kathode laufen die umgekehrten Prozesse ab. So weit die Theorie. In der Praxis sieht aber alles ein bisschen komplizierter aus. Wir müssen nämlich an Nebenreaktionen denken.
Je nach der Zusammensetzung der Legierungen bilden sich neben Cu(I) und Cu(II) natürlich auch Ionen von Ni(II) und Fe(II). Letztere können sogar noch weiter oxidiert werden zu Fe(III). Dazu ist Sauerstoff notwendig. Der bildet sich an der Anode parallel zu den Metall-Ionen durch Sulfat-Katalyse. Neben diesem Gas bilden sich auch Sauerstoffatome, Wasserstoffperoxid und weitere oxidierende Stoffe. Die Anode ist also von einem stark oxidierenden Medium umgeben.
Alle angesprochenen Metall-Ionen bilden auf diese Weise schwerlösliche und dunkelfarbige Oxide und Hydroxide, mit denen sich die Anode rasch überzieht. Die ständige Gasbildung führt dazu, dass dieser Überzug ständig abblättert und zu Boden sinkt. Das ist der in unserem Versuch beobachtete Anodenschlamm.
1717
F: Vielen Dank für Ihre freundliche Antwort auf meine letzte Frage.
Vielleicht darf ich noch eine Frage hinterher schicken - ich verspreche auch, es damit dann bewenden zu lassen. Es geht um den pH-Wert. Dieser gibt die Hydronium-Ionen-Konzentration an, wie man schon in der Schule lernt. Diese sind ja auch primär für den sauren Charakter einer Lösung bzw. eines Elektrolyten verantwortlich.
Wie ist es nun im Fall z.B. einer wässrigen Kupfersulfatlösung? Hier sind ja neben den durch die Autoprotolyse des Wassers gebildeten Wasserstoff-Ionen auch positiv geladene Kupfer-Ionen vorhanden. Diese verstärken ja vermutlich den sauren Charakter (der Dissoziationsgrad ist höher, die Konzentration der Ionen weicht stärker von der des Wassers im Neutralzustand ab, somit ist ein solcher Elektrolyt nach meinem Verständnis auch aggressiver). Ist bei einer solchen Lösung die Angabe des pH-Werts, der ja nur die Wasserstoff-Ionen erfasst, nicht irreführend, bzw. gibt es eine ähnlich definierte Größe, die alle positiven Ionen quantifiziert?
A: Der pH-Wert einer Kupfersulfatlösung beträgt 5,9 (20 °C). Die Lösung ist also schwach
sauer. Das liegt an der Protolyse des Kupfer-Ions, das als schwache Base mit Wasser ein schwerlösliches Hydroxid bildet.
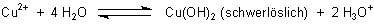
Sie können auch sagen, dass die in wässriger Lösung gebildeten Aquokomplexe des Kupfers aufgrund der starken zentralen positiven Ladung des Metall-Ions Protonen abgeben. Beispiel:
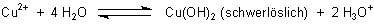
Zu Ihrer anderen Frage: Eine besondere Größe, die alle positiven Ionen erfasst/quantifiziert, gibt es nicht.
Ansonsten haben Sie Recht, dass sich die Anwesenheit von Fremd-Ionen jeglicher Ladung auf die pH-Wert-Messung auswirkt. Dazu muss man wissen, dass der pH-Wert nicht etwa die (logarithmierte) Konzentration der Hydronium-Ionen angibt, sondern deren Aktivität. Die ist im Allgemeinen geringer als die „Einwaage-Konzentration“. Informieren Sie sich hier: wasser/w-ph-sp.htm.
1718
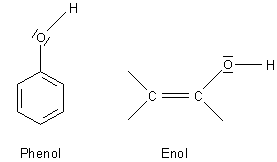
F: Worauf beruht der Nachweis von Phenol mit Eisen(III)-Salzen?
A: Es bilden sich je nach Phenolart unterschiedlich farbige Lösungen. Klicke
hier. Woher die Farbigkeit rührt, weiß man nicht genau. Aus den magnetischen Eigenschaften des Komplexes kann man aber herleiten, dass
es sich um einen Inner-Orbital-Komplex (Durchdringungskomplex) des Eisens handeln muss. Bemerkenswert ist, dass nicht nur Phenole,
sondern auch Enole diese Farbreaktion zeigen. Da die Hydroxylgruppe der beiden Stoffklassen sauer reagiert und neben der OH-Gruppe ein
ungesättigtes System liegt, muss diese Konfiguration zu der Farbbildung beitragen. Dabei liegen die Liganden wohl als Anionen vor.
1720
F: Ich musste heute einen Versuch zur Phosphorsalzperle machen und die Reaktionsgleichungen dazu
aufstellen.
Bei der Versuchsdurchführung gibt man zunächst Natriumdihydrogenphosphat an das Ende einer Magnesiarinne und erhitzt.
NaH2PO4 ---> NaPO3 + H2O + NH3
Danach gibt man im ersten Versuch Cobaltoxid Co3O4, im zweiten Teil MnO2 und erhitzt nochmals. Dabei
entweicht elementarer Sauerstoff, und jetzt tritt mein Problem mit den Reaktionsgleichungen auf:
Ich denke, dass im ersten Teil sowohl das Chrom zu Co2+ , als auch der Sauerstoff zu O2 oxidiert wird, und
das PO3- zu PO42- , allerdings komme ich auf keine sinnvolle Gleichung. Bemerkt war allerdings noch,
dass angeblich ein meta-Phosphat entstehen soll. Demzufolge habe ich jetzt:
i) NaPO3 + Co3O4 ---> 2O2 + 3Co(PO3) + 2Na+
, was ja nicht sein kann und
ii) 3 NaPO3 + MnO2 ---> 2O2 + Mn (PO3)3 + 3 Na+
, was noch schlimmer ist
Ich wäre Ihnen dankbar, wenn Sie mir die zwei obigen Gleichungen sagen könnten, die mit den blau markierten Edukten zu tun haben. Ich
bin mittlerweile echt verwirrt, da evtl. auch ein Polyphosphat entstehen könnte.
Vielen Dank für Ihre Hilfe
A: Es entweicht bei diesem Versuch auf keinen Fall elementarer Sauerstoff!
Die erste Gleichung ist richtig:
NaH2PO4 ———> NaPO3 + H2O + NH3
NaPO3 ist Metaphosphat. Das ist ein polymeres Phosphat, in dem der Phosphor die gleiche Oxidationsstufe (+V) hat wie im Phosphat.
Zu den Gleichungen für die anschließenden Reaktionen. Manchmal ist es unsinnig, solche Gleichungen aufzustellen, denn man kennt die Zusammensetzung der Produkte genau genommen nicht. Deshalb wird bei solchen „Schmuddelreaktionen“ nur formal geschrieben.
Co3O4
enthält Co(II)- und Co(III)-Ionen („CoO • Co2O3”)
NaPO3 + CoO ———> NaCoPO4
3 NaPO3 + Co2O3 ———> 2 CoPO4 + Na3PO4
Die erste Verbindung ist rosa, die zweite blau. Dass sich aber im Allgemeinen auch bei Co(II)-Salzen blaue Phosphorsalzperlen bilden, liegt an deren Oxidation durch Luftsauerstoff.
MnO2
enthält Mn(IV)-Ionen
2 NaPO3 + MnO2 ———> Na2Mn(PO4)2
Das Phosphat ist braun gefärbt.