 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1726
F: Erdalkali-Carbonate MCO3 und Erdalkali-Chromate MCrO4 sind
ähnlich schwerlöslich wie die Sulfate. Im Gegensatz zu diesen sind sie jedoch in Säuren leicht löslich. Wie lässt sich dieser
Sachverhalt erklären??
A: Man sollte streng Löslichkeit und Zersetzung unterscheiden. In Wasser lösen sich
die genanten Salze reversibel. Das heißt, es handelt sich um einen physikalischen Vorgang. Die Carbonate sind deshalb in Säuren
„löslich“, weil die Protonen im Kontakt mit den Carbonat-Ionen des Kristalls Kohlensäure bilden, die sofort unter
CO2-Freisetzung zerfällt. Deshalb sprudeln die Carbonate in Säuren oberflächlich auf. Damit zerfällt natürlich
auch das Kristallgitter. Carbonate zersetzen sich also in Säuren irreversibel - das ist ein chemischer Prozess, Chromat-Ionen
sind prinzipiell ähnlich gebaut wie Sulfat-Ionen, so dass wir in Wasser eine Stabilitätskaskade wie bei den Sulfaten
(MgSO4 in Wasser leicht löslich, CaSO4 weniger, SrSO4 kaum, BaSO4 schwerstlöslich)
sehen. Das heißt, dass deren Löslichkeitsprodukte immer kleiner werden.
Die Löslichkeit der Sulfate wird nicht durch Säuren beeinflusst, wohl aber die der Chromate - wie Sie richtig beschreiben.
Der Unterschied liegt in den Anionen liefernden Säuren.
Schon im schwach sauren Milieu bildet sich im chemischen Gleichgewicht aus Chromat Dichromat, das sich nicht mit den Erdalkalimetall-Ionen verbindet.
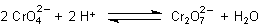
Dieses Gleichgewicht kann man durch die Variation der Protonenkonzentrationen beliebig verschieben. Damit können wir auch die Konzentration des Chromats vergrößern oder verkleinern. Das hat Auswirkungen auf die Festkörperbildung bzw. -stabilität.
Diese Reaktion findet auch mit den Chromat-Ionen, die mit dem Erdalkalichromat-Kristall im Lösungsgleichgewicht vorliegen, statt.
Wenn wir also den pH-Wert der Lösungsumgebung der Chromate ins Saure verschieben, liegen nicht genügend freie Chromat-Ionen vor, die mit den Erdalkali-Ionen schwerlösliche Niederschläge bilden können. Anders gesagt: Deren Löslichkeitsprodukt wird nicht erreicht. Der Kristall zersetzt sich.
Das macht man sich umgekehrt zunutze, um Gemische von Sr2+ und Ba2+ zu trennen: Man nimmt die Fällung unter abnehmender Acidität vor, zum Beispiel in Gegenwart einer entsprechenden Reihe von Essigsäure/Acetatpuffern. Im sauersten Milieu (Essigsäure) fällt das am schwersten lösliche Ba-Chromat (Löslichkeitsprodukt L = 8,5 • 10-11). Das trennt man ab. Dann puffert man die saure Lösung mit Acetat, dann fällt auch das Sr-Chromat (L = 3,6 • 10-5).
1727
F: Als Anodenmaterial verwendet man beim Galvanisieren das Metall, mit dem der als Kathode
geschaltete metallische Gegenstand überzogen werden soll. Worin liegt der Vorteil gegenüber Graphit als Anodenmaterial?
A: Täte man das nicht, gäbe es nach kurzer Zeit kein Metall-Ion mehr in der Lösung,
das sich auf der Kathode abscheiden könnte. Folge schon bei zunehmender Konzentrationsminderung: Die Elektrode fängt an zu gasen
(H2-Bildung durch Protonen-Entladung). Das stört die weitere Abscheidung von etwaig in der Lösung noch vorhandenen
Metall-Ionen.
Die anodische Oxidation (Zersetzung) der Elektrode führt dazu, dass die Konzentration der Metall-Ionen immer konstant bleibt.
1728
F: Blaues Kalium ?
Bei einem Unterrichtsversuch mit Kalium habe ich eine mir unerklärliche Beobachtung gemacht: Von einem großen Kaliumbrocken (neu)
aus der Vorratsflasche mit Paraffinöl habe ich ein Stück abgeschnitten und in einem Becherglas mit Petroleum "zwischengelagert".
Dabei färbte sich dieses Stück langsam blau. Auch beim Durchschneiden wurde die Schnittstelle schnell blau.
Können Sie sich das erklären? Wenn ja, bitte antworten
A: Es handelt sich um Anlauffarben. Kalium ist ein sehr unedles Metall. Frische Schnittstellen
korrodieren augenblicklich, das heißt, sie bilden mit Wasser und Sauerstoff (die ja auch im Petroleum enthalten sind, vor allem wenn es
wie bei Ihnen offen im Becherglas steht) einen Überzug von Oxid bzw. Hydroxid. Diese Schichten sind zunächst sehr dünn. Sie beugen wie
alle dünnen Schichten das eingestrahlte Licht. Durch Interferenzen gibt es die bekannten Farbmuster. Ich erinnere an farbige Seifenblasen
und Ölfilme. Klicken Sie hier.
Es gibt auch andere Metalle, die diesen Effekt zeigen: Nickel oder schwach und kurzfristig erhitztes Kupfer sowie manche Edelstahlsorten nach Erhitzen. Bekannt sind vielen die Anlauffarben von Antimon oder von Bismut.

Anlauffarben auf geflexten Stahlstücken
(Foto: Blume)
1729
F: Betreff: Nachweis von Ruß
Im Chemieunterricht haben wir verschiedene Metalle erwärmt (Eisennagel, Eisenwolle, Kupfer, Magnesium).
Nach dem Erhitzen von Kupfer entstand eine schwarze Schicht auf dem Kupfer. Wir überlegten mit unseren Lehrer, ob es Ruß ist, oder
ob es durch das Kupfer entstanden ist. Können Sie uns sagen, ob es vom Kupfer kommt oder ob es Ruß ist?
A: Am Entstehen des schwarzen Belags ist tatsächlich das Kupfer beteiligt. Es handelt sich
um Kupferoxid. Das könnt ihr zeigen, indem ihr das schwarze Pulver abkratzt und in verdünnter Salz- oder Schwefelsäure löst. Ihr könnt
auch das ganze Kupferstück in die Säuren legen. Dann wird das Kupfer wieder ganz blank. (Wichtig: Kupfer wird als halbedles Metall
von diesen Säuren nicht so rasch angegriffen.) Es entsteht eine grüne Lösung. Wenn Euer Lehrer dazu Ammoniakwasser gibt, wird die
Lösung tiefblau. Das ist typisch für Lösungen von Kupfersalzen.
Ruß ist Kohlenstoff; der löst sich nicht in Säuren. Anders als Kupferoxid könnt ihr Ruß verbrennen.
Euer Lehrer soll euch den Versuch mit dem Kupferbrief zeigen. Da seht ihr, dass der schwarze Belag des Kupfers in der Hitze durch Reaktion mit der Luft entsteht. Es gibt übrigens auch einen roten Belag des Kupfers.
1730
F: Ich bin in der neunten Klasse im Gymnasium und wir behandeln gerade das Thema Schokolade
in NWT. Nun wollte ich wissen, warum sich Fette in Fetten lösen. Oder mischen sich Fette nur untereinander? Wasser
ist ja polar und löst deshalb andere polare Stoffe, das ist mir klar, wie das funktioniert. Aber wie lösen sich unpolare Stoffe
untereinander?
Vielen Dank im voraus für eine Antwort!
A: Eine Lösung ist eine feinstverteilte („molekulardisperse“) Mischung von Stoffen.
Die Feststoffe, die gelöst werden sollen, bestehen aus Molekülen oder anderen Teilchen wie Atome oder Ionen, die untereinander Wechselwirkungen, also bestimmte Bindungskräfte aufweisen. Das hält die Moleküle/Atome/Ionen und damit den Festkörper zusammen. Wenn man sie voneinander lösen will, muss man Lösemittel zugeben, die die gleichen Wechselwirkungen aufweisen. („Gleiches löst sich in Gleichem.“) Wie das mit den Molekülen des Wassers funktioniert, die als elektrische Dipole wirken und zum Beispiel Ionen eines Salzkristalls auseinander treiben, hast du verstanden.
Fettmoleküle (und auch Wachse sowie feste Kohlenwasserstoffe wie Paraffin) werden durch so genannte van der Waals-Kräfte zusammengehalten. Das betrifft natürlich auch Flüssigkeiten wie Benzin. Du weißt sicherlich schon, dass in Atomen und Molekülen negativ geladene, bewegliche Elektronen vorhanden sind. Stell dir als einfaches Modell vor, dass diese um die Atome und auch Moleküle kreisen. Dabei kann es zur unregelmäßigen Verteilung der Ladungen kommen: Hier ist mal die Ecke eines Moleküls negativ, dort eine Ecke des benachbarten Moleküls positiv geladen… Die Folge: Die Moleküle ziehen sich (wenn auch nur ganz schwach) an.
Fettlösemittel sind z. B. Ethanol oder Benzin. Diese sind ebenfalls in der Lage, van der Waals-Bindungen aufzubauen. Die Moleküle dieser Lösemittel drängeln sich zwischen die der Fettmoleküle im Kristall, umhüllen sie wie ein Käfig und lösen sie so voneinander - so wie es auch die Wassermoleküle bei Salz- oder Zuckerkristallen machen.