 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1756
F: Ich habe letztens zum ersten Mal von Franzbranntwein gehört. Er soll bei
äußerer Anwendung gegen Schwellungen, Verspannungen, Muskelkater, Zerrungen, Entzündungen und sogar Hämatome helfen.
Ich habe recherchiert und konnte nur die Inhaltsstoffe herausfinden (bei 100 ml: 0,91 g Menthol; 0,19 g Campher;
47,36 g Ethanol (70 %), Wasser und nach Belieben noch mit diversen ätherischen Ölen versetzt).
Doch gab mir das nicht Aufschluss, warum Franzbranntwein denn nun bei Beschwerden hilft, die auch unterhalb der
Hautoberfläche liegen wirken sollen. Dafür müsste doch ein Inhaltsstoff in das schmerzende Gewebe eindringen, um
Linderung zu verschaffen. Oder ist es in der Tat nur die kühlende Wirkung von Ethanol und Menthol, die gegen
Schmerzen helfen?
A: Zu Ihrer Frage: Als Mischung fettlösender Substanzen kann Franzbranntwein
durchaus die Haut durchdringen und so ins Körpergewebe gelangen. Wenn Sie nach extensiver Franzbranntweinanwendung in
eine Alkoholkontrolle geraten, wird es für Sie wegen Ihrer Blutalkoholwerte eng.
Franzbranntwein war früher in jedem Haushalt zu finden. Franzbranntwein fördert meines Erachtens nach nur die Durchblutung. Er wird deshalb in vielen Krankenhäusern zur Dekubitus-Prophylaxe verwendet, soll also bei langzeitlägerigen Patienten Liegewunden vorbeugen. Außerdem soll es wegen der Kälte/Wärme-Reize den Kreislauf anregen.
Manche Leute reiben damit auch ihre Kopfhaut ein, um Schuppenbildung vorzubeugen. Das Massieren allein würde nach Meinung von Dermatologen schon ausreichen, um die Durchblutung der Kopfhaut zu verstärken. Da Schuppenbildung aber eher eine Pilzerkrankung ist, hilft auch das nur wenig.
Der Franzbranntwein soll weiterhin bei rheumatischen Beschwerden helfen (es gibt einen Campher-Spiritus mit höherem Campheranteil). Hier steht wohl die antiseptische Rolle dieser Substanz im Mittelpunkt. Aber das ist meines Wissens nach umstritten.
Der Namensteil Franz steht übrigens für Französisch (lateinisch: spiritus vini gallici). Früher bezeichnete man damit ein Brennprodukt aus schlechtem Wein, dem man zur Geschmacksverbesserung die von Ihnen genannten Aromastoffe hinzufügte. Auch heute noch wird Franzbranntwein (Mindestalkoholgehalt: 32 %) durchaus getrunken. Frei verkäuflicher F. muss deshalb vergällt werden - zum Beispiel mit Kochsalz.
1757
F: Wie reagieren Kohlenhydrate auf Wasserstoff. Gibt es dazu auch Literatur?
MfG.
A: Mit Wasserstoff allein reagieren Kohlenhydrate nicht. In Gegenwart von
Katalysatoren wie feinverteiltem Platin (bzw. Palladium oder vor allem auch Nickel) sowie in aktivierter Form wie
Natrium-Borhydrid (NaBH4) oder Lithium-Aluminiumhydrid (LiAlH4) reagiert Wasserstoff.
Darüber berichtet jedes gängige Lehrbuch zur organischen Chemie. Es handelt sich bei den Monosachariden um die üblichen Reduktionsreaktionen von Carbonylverbindungen. Zum Beispiel entsteht so aus Glucose der Zuckeralkohol Sorbit.
Komplizierter und nur selten beschrieben ist die Reduktion von Glykosiden. Im Allgemeinen kommt es im Verlauf der Addition von Wasserstoff zu einer Spaltung der Glykoside, wobei statt der Kohlenhydrate deren Alkohole entstehen dürften.
1758
F: Welcher Stoff ist für die blaue Fluoreszenz bei der Leuchtprobe auf Zinn verantwortlich?
Das habe ich auch schon recherchiert, aber keine eindeutige Lösung gefunden. Die einen sagen es ist SnH4, die
anderen sagen es ist SnCl2 und wieder andere meinen es ist SnCl4.
Bitte helfen sie mir!
Vielen Dank im Voraus, dass Sie sich für meine Fragen die Zeit nehmen und Vielen Dank im Voraus für die Lösung.
A: Hier ist für Laien die Beschreibung der Leuchtprobe: Die zinnhaltige Analysensubstanz
wird mit etwas verdünnter Salzsäure (c = 2 mol/l) und einer Zinkgranalie versetzt. Man kann auch eine Lösung von Zinn(II)-chlorid
in verdünnter Salzsäure nehmen. Dann wird ein mit kaltem Wasser gefülltes Reagenzglas in die Lösung getaucht und kurz in die
entleuchtete Flamme eines Bunsenbrenners gehalten. Man erkennt eine leuchtendblaue Lumineszenz. Vorsicht: Gefahr von Siedeverzügen.
Der Versuch geht nur mit einem kalten Reagenzglas.
Es gibt keine gesicherte Theorie, wie die blaue Lumineszenz der Leuchtprobe entsteht. (Wahrscheinlich interessiert es keinen Wissenschaftler so richtig...)
Auf jeden Fall ist es wohl irrig, wenn von Zinn(IV) ausgegangen wird - weil nur Zinn(II)-salze (vor allem -chlorid) diesen Effekt zeigen. Sie zeigen es auch ohne die Anwesenheit von Reduktionssystemen wie Zink/HCl -> Wasserstoff. Diese gibt man bei der qualitativen Vorprobe zu, um in der Analysenprobe etwaig vorliegende Zinn(IV)-Verbindungen aufzuschließen und zu dem eigentlich lumineszierenden Zinn(II) zu reduzieren.
Bei der Leuchtprobe mit reinem SnCl2 dient die Salzsäure nur als Lösemittel, weil sich im neutralen Milieu schwerlösliches Zinn(II)-chlorid-hydroxid („basisches Salz“) bildet.
Es handelt sich bei der Leuchterscheinung sicherlich um Energiefreisetzung im Rahmen der Oxidation von Sn(II) nach Sn(IV), also um Chemolumineszenz.
Interessant ist, dass man das Phänomen nur bekommt, wenn man mit einem wirklich kühlen Glas arbeitet.
1759
F: Sie haben da eine sehr schöne Chemieunterricht-Seite! Insbesondere alles, was über
die Kreide und Feuerstein erklärt wird, habe ich mit großem Vergnügen gelesen. Seit
ich klein war - das ist viele Jahre her - habe ich mich gefragt, wie die Feuerstein-Bänder in die Kreide kommen. Nun weiß ich
Bescheid!
Im letzten Dezember habe ich eine sehr schöne große Pyritknolle von ca. 3 kg am Sassnitzer Kreidestrand gefunden. Nach der
Lektüre Ihres Pyrit-Artikels meine ich nun, eine Markasitknolle zu haben. Und die fängt nun an, sich zu zerlegen.
Das ist natürlich ärgerlich. 60 Millionen Jahre unbeschadet in der Kreide und nach nicht mal einem Jahr hier in der hessischen
Provinz beginnt der Zerfall. Ich vermute, das liegt daran, dass der Pyrit nun mit Sauerstoff reagiert.
Wissen Sie eine Möglichkeit, die Pyrit/Markasitknolle dauerhaft zu konservieren? Es muss dieses Mal nicht wieder 60 Millionen
Jahre halten, ich bin mit - na sagen wir mal optimistisch: 60 Jahren zufrieden.
A: Da können Sie nichts machen. Der Zerfall von Markasit ist autokatalytisch, das heißt,
er beschleunigt sich selbst aufgrund der beim Zerfall entstehenden, katalytisch wirkenden Schwefelsäure (genau genommen: deren
Protonen). Ausgelöst wird er wahrscheinlich durch sulfurikante Bakterien, die Markasit „fressen“.
Die Schwefelsäure sorgt noch für ein weiteres Problem: Sie müssen daran denken, dass Sie das Stück nicht auf eine empfindliche Unterlage (Holz, Stoff, Papier, Metall...) legen, da die Schwefelsäure diese Materialien rasch angreift. Am besten geeignet sind Glas oder Steingut. Außerdem wird das Stück zunehmend hygroskopisch, zieht also Wasser an.
Lassen Sie sich nicht beirren. Sie sollten alle Schwefeleisen-Knollen („Konkretionen“), die Sie finden, aufsammeln. Meine Stücke, die ich zu Hause habe, sind bis auf eine Ausnahme stabil, da sie sich offenbar in den 60 Mio Jahren in Pyrit umgewandelt haben. Und das, obwohl ich sie durch mehrtägige Behandlung mit halbkonzentrierter Salzsäure entrostet habe...
Auf einer besonderen Webseite berichten wir darüber.
1760
F1: Welches Produkt erhalte ich wenn ich Sn mit halbkonzentrierter HNO3 reagieren
lasse? Ich hab schon überall gesucht aber nichts gefunden. Ich würde mich über eine Lösung sehr freuen.
A1: Halbkonzentrierte Salpetersäure ist eine starke Säure und zugleich ein Oxidationsmittel.
Es entsteht formal zuerst Zinn(II)-nitrat und dann letztlich Zinn(IV)-oxid („Zinnsäure“).
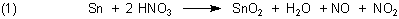
F2: Vielen Dank! Es ist wirklich sehr nett von ihnen, dass sie einen Teil ihrer Zeit dafür
aufwenden um Leuten mit Fragen zu helfen.
Ich hätte da noch eine Frage, weil ich mir da selbst nicht so ganz sicher bin, aber wenn ich jetzt SnO2 in HCl löse,
erhalte ich dann als Produkte SnCl4 und O2?
A2: Wenn Sie SnO2 mit heißer HCl behandeln, bekommen Sie Zinn(IV)-chlorid.
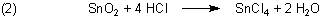
Dieses SnCl4 enthält Sn4+- und Chlorid-Ionen, ist also ein Salz. Entsprechend reagiert auch Schwefelsäure. Aber es entsteht auf keinen Fall Sauerstoff! Der Sauerstoff ändert seine Oxidationszahl (-II) nicht.
Kovalent aufgebautes SnCl4 dagegen erhalten Sie, wenn Sie Zinnmetall mit elementarem Chlor umsetzen. Mit Wasser reagiert diese rauchende Flüssigkeit zu SnO2 und HCl, in geringem Umfang auch zu Sn4+ oder zu SnO2+.