 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1786
F: In einer Hauptschulklasse 9 haben wir den Versuch mit der Schwefelsäure auf Zucker gemacht.
Brav habe ich die Formel aufschreiben lassen und erklärt, dass das schwarze "Monstrum" nun reine Kohle sei. Ein Schüler wollte dann
wissen, ob es brennt. Vorsichtshalber sind wir raus und haben versucht, die schwarze Kohlewurst mit dem Butanbrenner anzuzünden.
Es hat aber nicht geklappt. Die aufgeplusterte Kohle hat nicht mal geglüht; es zeigte sich optisch gar keine Reaktion. Könnten Sie
mir dieses Phänomen bitte erklären?
Ich bedanke mich schon mal im Voraus für Ihre Zeit und Mühe und im allgemeinen für Ihre tolle(n) Seite(n). Gerne werde ich Ihnen
auch Rückmeldung geben.
A: Es handelt sich bei der Zuckerkohle tatsächlich
weitgehend um Kohlenstoff, also nicht um Kohle im eigentlichen Sinne. Beide sollten brennen. Aber: Kohlenstoff brennt von
vornherein sehr schlecht. Versuchen Sie es z. B. mal mit einem Graphitstab... Bei brennbarer Kohle zum Heizen handelt es sich
um ein Gemenge von großmolekularen Kohlenwasserstoffen. Die brennen zwar viel besser; man muss den Ofen aber dennoch schon kräftig
vorheizen, z. B. mit Holz, um die Kohle zu entzünden. Das merke ich jeden Abend...
Zur Formel der Steinkohle klicken Sie hier.
Nun zu den Problemen bei Ihrem Versuch:
| 1. | Eine Butanbrennerflamme bringt nicht genügend Energie auf. Ein Erdgasbrenner mit großer, entleuchteter Flamme wäre besser geeignet. Vor allem sollten Sie auch im Chemieraum arbeiten, weil es draußen zu kalt und windig ist und der Flamme dadurch zusätzlich Energie entzogen wird. |
| 2. | Dann ist zu bedenken, dass die Zuckerkohle feucht ist und sich nicht so rasch trocknen lässt, weil die in der Kohle enthaltene Schwefelsäure das Wasser festhält. Man muss schon sehr lange erhitzen, um die Schwefelsäure samt Wasser auszutreiben. So lange kann man die Kohle nicht zum Glühen bringen. |
| 3. | Wenn Sie also die Zuckerkohle anzünden wollen, müssen Sie die Kohle zunächst gut auswaschen (bis das Waschwasser neutral reagiert) und dann wirklich gut trocknen. Dann können Sie es noch einmal versuchen. |
Aber ich glaube, dass Ihre Schüler das auch ohne Versuch verstehen...
1787
F: Darf ich mich wieder mit einer Frage an Sie wenden?
Wir kamen in meinem Chemie-Kurs (Kl.12) kürzlich auf das Thema "Eisbonbons" und die Frage, was den kühlenden Effekt im Mund
eigentlich bewirkt ... entropischer Effekt, ätherisches Öl oder ist der sogar mehr 'virtuell'?
Vielleicht können Sie mir ja freundlicherweise weiterhelfen!
Langes Herumsuchen im Internet hat mir leider nichts gebracht.
A: Es handelt sich um die physiologische Wirkung von in ätherischen Ölen enthaltenen
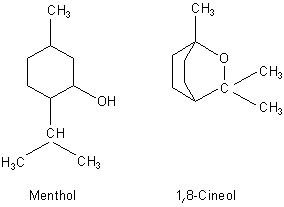
gesättigten Terpenen wie L-Menthol (aus Pfefferminzöl). Dessen Geruch wird nicht nur als süß-minzig, sondern dazu noch als kühl
und frisch*) beschrieben. Hinzu kommen noch Inhaltsstoffe des Eucalyptusöls, z. B. 1,8-Cineol, das campherartig riechen soll.
Lebensmittelrechtlich bestehen gegen diese Inhaltsstoffe keine Bedenken.
Hinzu kommen noch Säuerungsmittel wie Citronensäure, die „erfrischend“ schmecken.
Das eisartige Aussehen der Bonbons tut ein Übriges und ist wohl unter „Psychologie“, also „virtuell“ einzuordnen.
“Entropische Effekte“ spielen zwar immer eine Rolle; hinsichtlich ihrer Auswirkung sind sie doch meist an den Haaren herbeigezogen.
*) H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie; Springer-Verlag, 6. Auflage, Berlin Heidelberg New York 2008.
1788
F: Ich schreibe derzeit meine Facharbeit in Chemie. Leider verzweifle ich derzeit an der
Versuchserklärung zur Iodkammer. Mein Versuchsaufbau war folgender:
Eine DC-Platte (mit Kieselgel beschichtet), auf der Fingerabdrücke waren, habe ich in einer DC-Entwicklungskammer Ioddämpfen
ausgesetzt. Nach kurzer Zeit wurden die Fingerabdrücke als braune Flecken sichtbar.
Nun zu meiner eigentlichen Frage. Ich habe viel über dieses Thema gelesen und werde immer verwirrter. Einmal heißt es,
dass überhaupt keine chemische Reaktion stattfindet, sondern dass die Anlagerung nur auf Adhäsionskräften (Adsorption) beruht.
Ein anderes Mal wiederum heißt es, dass die braunen Flecke aufgrund einer Additionsreaktion von Iod an den ungesättigten Fettsäuren,
die sich im Fingerabdruck befinden, entstehen.
Was ist denn nun richtig?
A: Es handelt sich vor allem um die physikalische Adsorption der Iodmoleküle an Fette.
Ursache sind van der Waals-Bindungen. Daher rührt die braune Farbe, die man auch beobachtet, wenn man Iod in Kohlenwasserstoffen löst.
In Lösemitteln wie halogenierten Kohlenwasserstoffen, die die Ausbildung von Molekülkomplexen erlauben, löst sich Iod ebenfalls -
aber in lila Farbe.
Dagegen führt an Doppelbindungen chemisch addiertes Iod zu farblosen (bzw. allerhöchstens gelblichen) Verbindungen.
1789
F: Ich habe gerade den Hauptteil meiner Facharbeit in Chemie über die chemisch-physikalischen
Vorgänge bei der Fleckentfernung aus Textilien abgeschlossen. Dabei habe ich auf die Wirkungsweise von alltäglichen Hausmitteln
dargestellt. Bei der Recherche über die Beseitigung von Rotweinflecken mit Speisesalz bin ich auch auf Ihren
Tipp des Monats Nr. 77 gestoßen. Darin schreiben Sie, dass "im alkalischen Milieu ... ein
Großteil der adsorbierten Rotweinfarbstoffe gelb gefärbt" wird. In Klammern steht noch "chemische Reaktion" geschrieben. Eben
diese würde mich interessieren, auch wenn ich gar nicht weiß, ob ich die Erklärung aus platztechnischen Gründen noch in meine
Facharbeit schreibe. Aber weil ich mich jetzt schon so lange intensiv mit diesem Thema beschäftigt habe, würde ich es auch
einfach so gerne wissen. Spielen die Hydroxidionen eine Rolle? Werden die konjugierten Doppelbindungen der Chromophore im
Farbstoff zerstört? Oder ist der Rotweinfarbstoff gar ganz anders aufgebaut?
Ich bin schon sehr gespannt auf Ihre Antwort.
Im Voraus schon einmal vielen Dank für Ihre Bemühungen und sehn Sie sich nicht gezwungen, mir so schnell wie es geht zu antworten, nur weil ich geschrieben habe, dass ich gerade über meiner Facharbeit sitze. Auch nach Facharbeitsabgabe interessiere ich mich immer noch für die Antwort auf meine Frage.
A: Es handelt sich um eine chemische Reaktion, bei der die im Rotwein enthaltenen
Anthocyan-Moleküle irreversibel abgebaut werden. Zuerst greift ein Hydroxid-Ion die Stelle neben dem Ring-Sauerstoffatom des
Chromanrings an. Es folgt die Abspaltung des phenolischen Benzolrests unter Bildung von Polyphenolen wie Hydrochinon. Diese
werden vor allem im alkalischen Milieu durch Luftsauerstoff leicht oxidiert, wobei entstehen Anthocyane klicken Sie den
Tipp des Monats Nr. 111 an.
1790
F1: Zunächst einmal - Ihre Webseite ist ein unerschöpflicher Ratgeber und eine Riesenhilfe für
"frische, junge" Chemielehrer wie mich, die tagtäglich auf der Suche nach schönen Versuchen und deren Machbarkeit sind! Super, dass
die Versuche wirklich allermeistens funktionieren - wenn nicht, liegt das wohl eher an den alten Chemikalien der Schulen...
Nun aber eine Frage, auf die ich keine Antwort finde (auch nicht durch Kollegen oder Literatur):
Zur Katalysatorwirkung ist ja in der Anfangschemie der Versuch mit Zucker und Asche sehr nett. Aber nun meine Frage: Was bewirkt
bei dieser Reaktion die Asche, dass der Zucker plötzlich doch brennt?
Wir sind schon auf verschiedene Möglichkeiten gestoßen wie z.B., dass Kaliumionen in der Asche katalysieren oder auch, dass ein
Kapillareffekt durch die trockene Asche und große Oberfläche vorliegt.
Wissen Sie dazu etwas?
Über eine Antwort würde ich mich sehr freuen - ein gutes neues Jahr noch und ich hoffe, die webseite bleibt weiter bestehen!!!
A1: Es handelt sich bei der Asche um einen Redox-Katalysator. Zum Verstehen der Wirkung müssen
Sie sich etwas tiefer in den elektronischen Aufbau der Alkalimetalloxide hineindenken: Metalloxidische Festkörper sind elektronische
Halbleiter. Die Elektronen befinden sich auf Leitungsbändern, die den Molekülorbitalen bei „normalen“ Molekülen entsprechen. Zunächst
kommt es wohl zu einer Adsorption von Sauerstoffmolekülen und Zuckerkristallen. Die energetischen Verhältnisse der Leitungsbänder der
Alkalimetalloxide bewirken, dass die Elektronenübertragung der Redoxreaktion zwischen Sauerstoff und Zucker besonders leicht funktioniert
und in großem Umfang stattfindet.
Lesen Sie hierzu unsere Webseite und Webseite.
F2: Vielen herzlichen Dank für die schnelle und informative Antwort und - sorry, dass ich
bei den jeweiligen Seiten nicht schon selbst die Lösung gefunden hatte, aber Ihre webseite ist so vielseitig, dass man gar nicht mehr
alles ansehen kann.
Auf jeden Fall fand ich es super, wie schnell Sie geantwortet haben, und dass ich nun endlich die Lösung für diesen "einfachen"
Versuch kenne - und ich habe sie gleich an einen Kollegen weitergeleitet (die email), der auch begeistert war!