Wie man brennende Metalle löscht
Experimente:
Versuch: Metalle brennen
Versuch: Pyrophores Eisen
Versuch: Magnesium brennt im Wasserdampf
Versuch: Die Wasserzersetzung mit Magnesium
Versuch: Knallgasexplosion
Versuch: Magnesium reduziert CO2
Versuch: Magnesiumnitrid
Frage:
Meine Cousine fragte mich neulich nach ihrem letzten Chemie-Unterricht, warum
beim Löschen von brennendem Mg Knallgas entsteht. Da ich überfragt war, suchte
ich im Internet nach einer Antwort und stieß dabei auf ihre interessante Seite.
Nun meine Frage an Sie: Warum entsteht Knallgas beim Löschen? Entsteht
Knallgas, weil Wasser und Mg miteinander reagieren, oder ist es die hohe
Temperatur, die das Wasser spaltet?
Antwort:
Vorneweg: Nicht nur Magnesium brennt. Gleiche Überlegungen gelten auch für
Aluminiumbrände. Und natürlich auch für brennende Alkali- und Erdalkalimetalle (->
Versuch). Sogar Eisen brennt, wenn es entweder fein genug
verteilt ist (-> Versuch) oder hoch genug erhitzt wird.
Brennendes Magnesium entwickelt Temperaturen von weit über 2000 °C. Das reicht an und für sich schon aus, um etwa 10 % der Wassermoleküle in Wasserstoff und Sauerstoff zu spalten. Das sind bekanntlich die Komponenten von Knallgas.
Wichtiger ist jedoch, dass erhitztes Magnesium mit Wasser reagiert, indem es dem Wasser den gebundenen Sauerstoff entreißt. (Diese Reaktion spielt in der Schulchemie eine Rolle bei der Analyse von Wasser; -> Versuch.) Grund: Magnesium ist unedler als Wasserstoff; der Prozess ist sogar exotherm!
Mg + H2O ———> MgO + H2 + Energie
Deshalb brennt Mg sogar sehr gut in Wasserdampf (-> Versuch) oder unter Wasser weiter; letzteres nutzt man zur Herstellung von Magnesiumfackeln für Taucher.
Der entstehende Wasserstoff vermischt sich mit aus der Luft hinzukommendem
Sauerstoff und bildet Knallgas (-> Versuch).
Das explodiert.
Mit Wasser kann man also keinen Magnesiumbrand löschen; man entfacht das
Feuer dadurch nur noch umso mehr.
Man kann nur überlegen, welche Möglichkeiten es gibt, den Brand zu löschen. Dazu lassen wir die gängigen Löschmittel Revue passieren.
1 Besonders schlimm sind die Auswirkungen des Versuchs, Metallbrände mit Halonen, also halogenierten Kohlenwasserstoffen, zu löschen. Hierbei bilden sich hochreaktive Carbene, Kohlenstoffverbindungen mit einem freien Elektronenpaar.
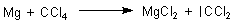
(Das geht mit den Alkalimetallen schon in der Kälte. Vor dem früher beliebten Versuch wird wegen der extremen Explosionsgefahr gewarnt!)
2 Da ist dann noch das Löschmittel Kohlenstoffdioxid. Das reagiert leider ebenso mit Magnesium (-> Versuch).
Mg + CO2 ———> 2 MgO + 2 C
3 Auch Stickstoff reagiert mit Mg unter Bildung von Nitriden (-> Versuch).
3 Mg + N2 ———> Mg3N2
Die gleichen Effekte beobachtet man mehr oder weniger ausgeprägt auch bei den anderen brennbaren Metallen. Selbst glühendes Eisen zersetzt Wasserdampf, wie der berühmte Versuch von Lavoisier zur Ermittlung der Zusammensetzung von Wasser gezeigt hat.
Deshalb gilt für das Löschen von Metallbränden folgende Regel:
Den Brand mit Sand oder Zement (natürlich beide trocken!!!) abdecken. Dann
ausbrennen lassen, bis Sauerstoff und Stickstoff verbraucht sind.
Aus diesem Grunde muss im Chemielabor immer Sand zur Hand sein. Zement ist in diesem Fall nicht so gut geeignet, da er bei längerer Lagerung klumpig und hart wird.
Eine weitere Möglichkeit zum Löschen von Metallbränden besteht in der Anwendung von Argon, einem gar nicht seltenen Edelgas. Es ist zu 0,93 Vol% in der Atmosphäre vorhanden und dient somit nicht nur als Schutzgas beim Schweißen.
Weitere Texte zum Thema „Sicherheit im Chemiesaal“