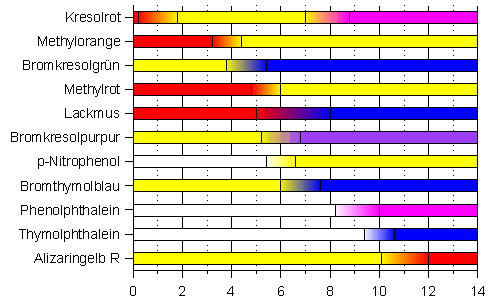
Säure-Base-Indikatoren
Was ist ein Säure-Base-Indikator?
Säure-Base-Indikatoren sind chemische Substanzen, mit deren Hilfe man feststellen kann, ob es sich
bei einer (unbekannten) Lösung um eine Säure oder Base handelt.
Dabei sind die Indikatoren selbst schwache Säure-Base-Systeme, bei denen die Base eine andere Farbe zeigt als die Säure.
Einer der bekanntesten Säure-Base-Indikatoren ist Lackmus. Gibt man eine Lackmus-Lösung zu einer Säure, so färbt sich die Lösung rot. Färbt sich eine Lösung bei Zugabe von Lackmus hingegen blau, so handelt es sich bei der Lösung um eine Base. Man kann sich also folgende Regel merken:
"Lackmus färbt Säuren rot und Basen blau."
Neben Lackmus gibt es noch eine Vielzahl weiterer Säure-Base-Indikatoren. Sie unterscheiden sich

Die exakten Werte können in einer ausführlicheren Tabelle nachgeschlagen werden.
Wozu benötigt man Säure-Base-Indikatoren?
1) Bestimmung von pH-Werten
Einen einfachen Säure-Base-Indikator kann man nur bedingt zur Bestimmung von pH-Werten einsetzen:
Färbt sich z. B. der Indikator Methylrot bei der Zugabe zu einer unbekannten Lösung gelb, so
bedeutet dies, dass der pH-Wert der Lösung über 6,0 liegt. Eine genauere Bestimmung ist zunächst
nicht möglich. Man kann jedoch zu einer weiteren Probe der Lösung noch einen anderen Indikator
geben, z. B. Phenolphthalein. Bleibt die Lösung nun farblos, so kann man den pH-Wert der Lösung
auf den Bereich von 6,0 bis 8,2 eingrenzen. Nach diesem Prinzip funktionieren auch die
so genannten Universalindikatoren,
die auf der entsprechenden Seite näher erklärt werden.
2) Säure-Base-Titrationen
Der wichtigste Einsatzbereich von Säure-Base-Indikatoren ist die Säure-Base-Titration.
Es geht dabei um die Bestimmung der Konzentration einer Säure (bzw. Lauge) mit Hilfe einer
Lauge (bzw. Säure) bekannter Konzentration.
Der Verlauf einer solchen Titration kann mit Hilfe einer sog. Titrationskurve dargestellt
werden, in welcher man den pH-Wert der Lösung gegen den Verbrauch an Titriermittel aufträgt.
Titrationskurve für die Titration von 10 ml Salzsäure (c = 0,1 mol/l) mit Natronlauge (c = 0,1 mol/l)
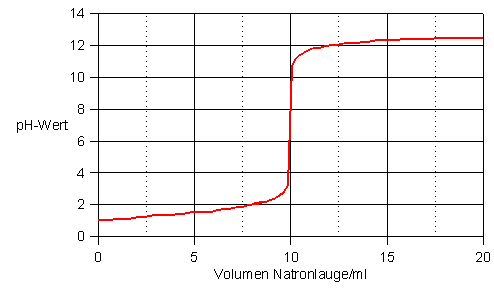
Besonders auffällig an der abgebildeten Titrationskurve ist der mittlere Bereich, in welchem
plötzlich ein steiler Anstieg erfolgt. Der Verbrauch an Natronlauge beträgt an dieser Stellegenau
10 ml, d.h. die 10 ml Salzsäure (welche ja die gleiche Konzentration wie die Natronlauge besitzt)
sind neutralisiert worden. Man nennt den zu dieser Stelle gehörenden Punkt einer Titrationskurve
auch den Äquivalenzpunkt. Dieser entspricht nur bei
starken Säuren dem Neutralisationspunkt.
Da bei einer Säure-Base-Titration die Konzentration der Säure (oder der Lauge) in der Regel nicht
bekannt ist, besteht die eigentliche Aufgabe in der Bestimmung der Lage des Äquivalenzpunktes.
Man benutzt hierzu einen Indikator, dessen Umschlagsbereich im Bereich des steilen Anstiegs der
Titrationskurve liegt. Im obigen Beispiel würden sich alle Indikatoren eignen, die im pH-Bereich
zwischen 4 und 11 umschlagen.
Der Verlauf einer Titrationskurve hängt jedoch stark von der jeweiligen Säure bzw. Lauge ab.
Titriert man z. B. Essigsäure anstelle von Salzsäure, so zeigt die Kurve einen anderen Verlauf:
Titrationskurve für die Titration von 10 ml Essigsäure (c = 0,1 mol/l) mit Natronlauge (c = 0,1 mol/l)
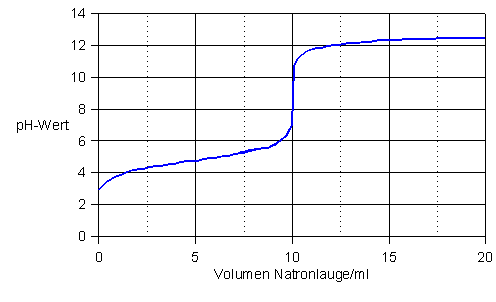
Äquivalenzpunkt und Neutralisationspunkt fallen hier nicht mehr zusammen
Hier eignen sich nur Indikatoren, deren Umschlagsbereich im pH-Bereich zwischen 7 und 11 liegt.
Man erkennt sofort: Eine Säure-Base-Titration liefert nur dann verläßliche Ergebnisse, wenn
man einen passenden Indikator ausgewählt hat.
Noch komplizierter sind die Verhältnisse bei mehrprotonigen Säuren (Schwefelsäure, Phosphorsäure,
Zitronensäure usw.). Diese weisen mehr als einen Äquivalenzpunkt auf und die Wahl des Indikators
entscheidet darüber, welcher der Äquivalenzpunkte durch die Titration ermittelt wird.
Weitere Texte zum Thema „Indikatoren“