pH-abhängige Spektren und Fotometrische Titrationskurven
Experimente:
Versuch: Fotometrische Titration
Säure/Base-Indikatoren sind letztlich
schwache Säuren und Basen, also Stoffe, die in wässrigem Milieu in chemische
Säure/Base-Gleichgewichte eingebunden sind. Die Lage dieser Gleichgewichte wird durch Säure- bzw.
Base-Konstanten (pK-Werte) charakterisiert.
Wie kann man die pK-Werte ermitteln, um zum Beispiel Aufschluss über die Umschlagsbereiche der Indikatoren zu erhalten?
Eine direkte Titration mit Bürette und einem pH-Meter, wie wir es bei der Essigsäure kennengelernt haben, ist nicht möglich, weil sich viele der Indikator-Substanzen in Wasser kaum lösen.
Dennoch gibt es erstaunlicherweise Tabellen, in denen man die pKa-Werte von Indikatoren nachschlagen kann (z. B. im CRC Handbook*). Woher kennt man die Werte?
Dazu mussten die Leute eine fotometrische Titrationskurve der stark verdünnten Lösung des Indikators aufnehmen. Hierbei misst man die Änderung der Absorption von Licht (Extinktion) in Abhängigkeit vom pH-Wert. Das ist nur möglich, weil der Absorptionskoeffizient von vielen Indikatoren sehr hoch ist, so dass auch bei geringsten Konzentrationen das Mess-Signal des Fotometers ausreicht. Die purpurrote Farbe des Phenolphthaleins zum Beispiel erkennt man visuell (laut Römpp-Chemielexikon) noch in einer Verdünnung von 1:1 Million (wobei offen bleibt, was die 1 bedeutet…).
Indikatoren zeigen uns ihre gewünschte Umschlagsreaktion durch eine Farbänderung im sichtbaren Teil des Spektrums an. Folglich haben wir eine starke pH-Abhängigkeit des Verlaufs ihrer Absorptionsspektren. Hier sind drei Beispiele:
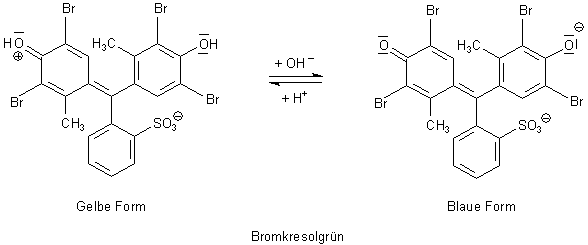
1 Bromkresolgrün
Dieser Indikator wird zum Beispiel bei Ozonmessungen eingesetzt. Klicke auch
hier. Er schlägt im pH-Bereich 3,8-5,4 um. Sein pKa-Wert ist 4,90.

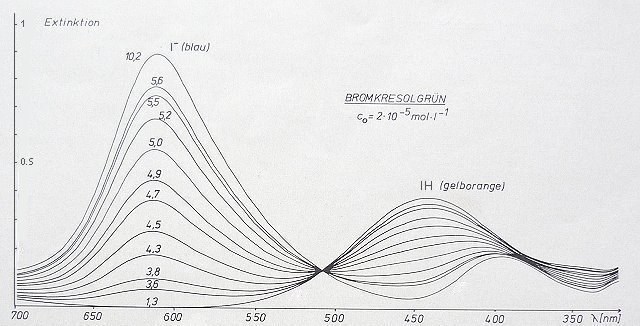
Bild 1: Titrationsspektren von Bromkresolgrün. Parameter ist der pH-Wert
2 Methylorange
Dieser Indikator dient vor allem zum Titrieren von Laugen und Basen (wie Ammoniak) mit Salzsäure. Sein
Umschlagsbereich liegt im Sauren zwischen den pH-Werten 3,2 und 4,4. Der pKa-Wert ist 3,46. Er ist sozusagen
das Gegenteil von Phenolphthalein, das mit einem pKa-Wert bei 9,5 im alkalischen
Bereich von pH 8,5-9,7 umschlägt.
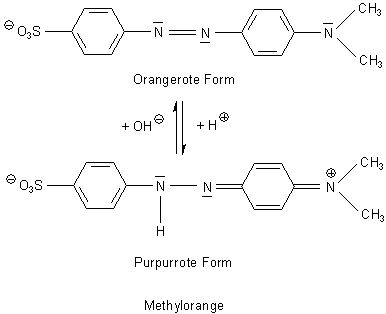
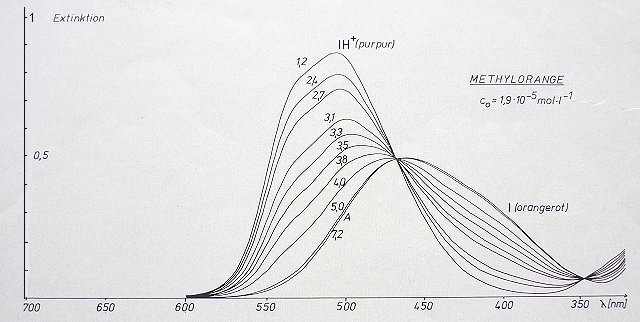
Bild 2: Titrationsspektren von Methylorange. Parameter ist der pH-Wert
3 p-Nitrophenol
p-Nitrophenol ist ein Indikator, der zwischen pH 5,4-6,6 umschlägt.
Sein Farbwechsel geht von Farblos (sauer) nach Gelb (neutral bis alkalisch). Sein pKa-Wert
liegt bei 7,15. Da er aber ein starkes Allergen ist, wird er nicht mehr so gern genutzt.
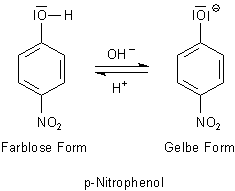
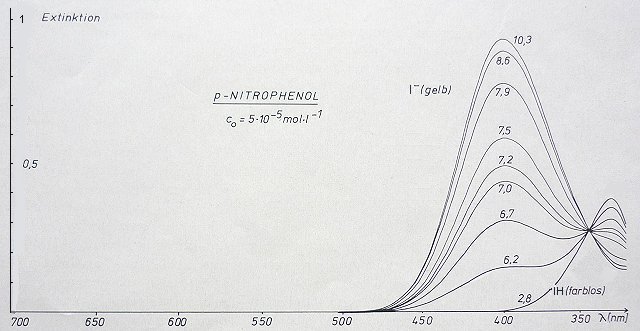
Bild 3: Titrationsspektren von p-Nitrophenol. Parameter ist der pH-Wert
Aber auch viele andere Säuren und Basen verändern ihre Absorption, wenn man den pH-Wert ihrer Lösung ändert.
Viele machen das nur im UV-Bereich des Spektrums. Beispiele sind die verschiedenen Carbonsäuren des Benzols.
Zunächst sucht man sich eine optimale Wellenlänge aus. Bei der Titration von p-Nitrophenol (Bild 3) wären das z. B. 400 nm. Wenn man dann die gemessenen Extinktionen gegen den zugehörigen pH-Wert aufträgt, erhält man eine Fotometrische Titrationskurve.
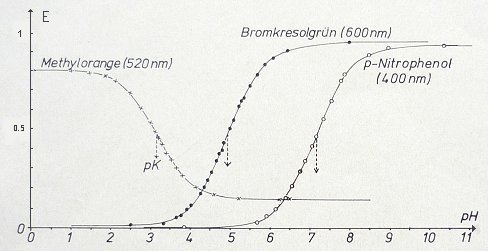
Bild 4: Aus den Spektren der Bilder 1-3 abgeleitete fotometrische Titrationskurven der Indikatoren
(Die Titrationskurve von Phenolphthalein findet man hier.)
Zu den Abbildungen der fotometrischen Titrationskurven
Anders als die Dissoziationsdiagramme sind die fotometrischen Titrationskurven verschieden hoch. Das liegt an den
unterschiedlichen Extinktionskoeffizienten der am Gleichgewicht beteiligten Substanzen.
Bild 6 zeigt die (berechneten und deshalb formalen) fotometrischen
Titrationskurven für den zweibasigen Indikator Thymolblau. Dieser zeigt die Farben
Rot (sauer) - Gelb (schwach sauer bis schwach alkalisch) - Blau (stärker alkalisch).
Seine Umschlagsbereiche liegen bei 1,2-2,8 sowie 8,0-9,6. Die pKa-Werte sind 1,65 und 9,20.
Das ganze Thymolblau-System zeigt Bild 5.

Bild 5: Farben des Indikators Thymolblau bei verschiedenen pH-Werten
(Foto: Daggi)
Je nach Wellenlänge erhalten wir für Thymolblau drei völlig unterschiedlich aussehende Titrationskurven.
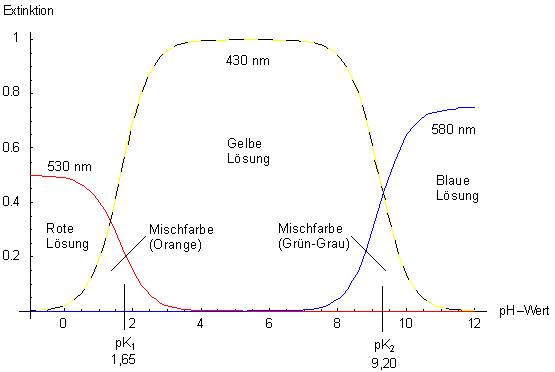
Bild 6: Fotometrische Titrationskurven des zweibasigen Indikators Thymolblau
bei drei verschiedenen Wellenlängen
(schematisch, berechnet)
- Im Sauren absorbiert die Lösung den blaugrünen Anteil des Spektrums, erscheint also rot.
- Um den Neutralpunkt herum absorbiert die Lösung Blau, ist also gelborange.
- Im Alkalischen ist die Lösung blau, weil sie Gelb-Orange absorbiert.
In den Zwischenbereichen überlappen die Kurven. Man erhält somit Mischfarben.
Man muss solche Titrationskurven auch als Gleichgewichtskurven
verstehen
Sigmoidale Gleichgewichtskurven zeigen die Eigenschaften der am
Gleichgewicht beteiligten Stoffe - wie zum Beispiel die Farben. Betrachten Sie dazu noch einmal Bild 5
und vergleichen Sie es mit Bild 6.
Bestimmung der pKa-Werte von Indikatoren
Den Kurven in Bild 4 kann man die pKa-Werte entnehmen. Sie entsprechen den pH-Werten,
bei denen die Extinktion gleich der Hälfte des Extinktionsumfangs der reinen Komponenten ist. Zu deren Messung muss
man die Farbstoff-Lösung auf einen pH-Wert einstellen, der mindestens 2-3 pH-Einheiten oberhalb und unterhalb des
(vermuteten) pKa-Werts liegt.
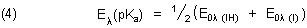
Wir zeigen das hier am Beispiel des Indikators Methylorange.
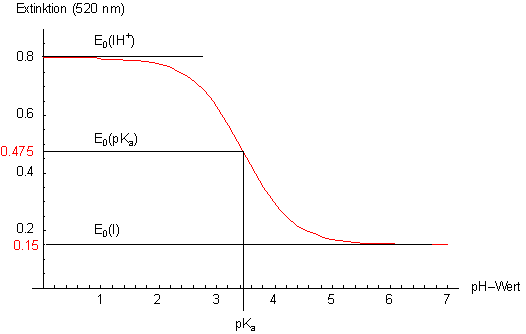
Bild 7: Grafische Ermittlung des pKa-Werts eines Indikators (Methylorange)
Natürlich gibt es auch eine der Henderson-Hasselbalchschen Gleichung analoge
Beziehung, in der statt Konzentrationen die Extinktionen auftauchen. Sie lautet:
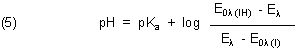
Diese Beziehung gilt auch für zweibasige Indikatoren. Voraussetzung dieser Näherung ist, dass die pKa-Wert-Differenz mindestens 2 beträgt. Vergleiche hierzu noch einmal Bild 6. Die pKa-Wert-Differenz ist dort 7,55. Man erkennt letztlich zwei formal unabhängige Säure/Base-Gleichgewichte.
Prinzip der Messung (-> Versuch)
Man stellt eine Lösung des Indikators her - möglichst einen Liter. Hierzu gibt es einen Trick: Weil die meisten
Farbstoffe in Wasser schwer löslich sind, löst man sie mit wenig Methanol (F,T) vor. Dann füllt man mit Wasser auf einen
Liter auf. Die Konzentrationen der Indikatoren liegen im Bereich von 10-4 bis 10-5 mol/l.
Als erstes ermittelt man die Extinktionen der reinen Komponenten. Hierzu gibt man mit einer Tropfpipette möglichst konzentrierte Natronlauge (oder Salzsäure) zu, um den Verdünnungsfehler gering zu halten. Der Wert der Extinktionen sollte zwischen 0,1 und 1 liegen. Man muss entsprechend verdünnen.
Nun zur eigentlichen Titration: Auch hier arbeitet man mit einer Tropfpipette und mit möglichst konzentrierter Natronlauge (oder Salzsäure). Am pH-Meter liest man ab, ob die pH-Wert-Änderung in Ordnung ist, sonst korrigiert man den pH-Wert mit etwas NaOH oder HCl. Manchmal reicht dazu das Eintauchen der mit Lauge oder Säure benetzten Tropfpipette in die gerührte Flüssigkeit aus. Nun spült man die Küvette mit dieser neu eingestellten Lösung drei bis vier Mal. Schließlich füllt man sie endgültig und säubert sie gut. Dann stellt man die Küvette ins Fotometer und nimmt das Spektrum auf - oder man misst die Extinktion bei einer ausgewählten Wellenlänge.
Wichtig: In der Nähe der pKa-Werte bzw. der Umschlagsbereiche muss man möglichst viele Messpunkte aufnehmen!
Berechnung der fotometrischen Titrationskurven
Wenn man die Extinktionen der reinen Komponenten und auch die pKa-Werte kennt, kann man die
Titrationskurven rechnerisch simulieren. Wie man das macht, beschreiben wir hier.
Literatur:
CRC Handbook of Chemistry and Physics. CRC-Press, Boca Raton, London, New York. (Achten Sie darauf, dass Sie bei
der Bestellung die jeweils neueste Jahres-Edition erhalten!)
Weitere Texte zum Phenolphthalein