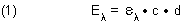
Zur mathematischen Simulation von Fotometrischen Titrationskurven
Experimente:
Versuch: Fotometrische Titration von Indikatoren
Der Algorithmus hierzu ähnelt dem der Dissoziationskurven schwacher Säure/Base-Systeme. Klicke
hier und hier.
Allerdings müssen wir hier statt der Konzentrationen den fotometrischen Messwert Extinktion einsetzen. Beide sind bekanntlich zueinander proportional. Das besagt das Lambert-Beersche Gesetz.
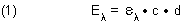
Die Extinktionen der reinen Säure bzw. der reinen korrespondierenden Base ist bei der gewählten Wellenlänge:
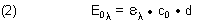
wobei co die Gesamtkonzentration des Indikators in der Lösung ist.
Die Extinktion und damit auch die Form der Titrationskurven hängen von der Wellenlänge ab. Das folgende Bild zeigt dies anhand der Titrationskurven einiger Indikatoren bei ausgewählten Wellenlängen.
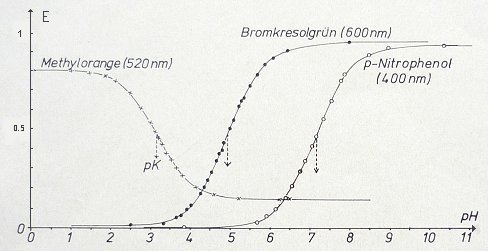
Fotometrische Titrationskurven verschiedener Indikatoren
Um das zu untersuchen, sollte man die mathematischen Funktionen der Titrationskurven ableiten, um mit ihnen zu „spielen“. Das betrifft auch die Möglichkeit, durch Simulation das Ergebnis einer Messung (-> Versuch) zu überprüfen.
1 Einbasige Indikatoren
Die saure Form eines Indikators ist eine schwache Säure IH („Indikatorsäure“). Das kann natürlich auch die
protonierte Form IH+ einer Indikatorbase I sein. Erinnern wir uns in diesem Zusammenhang an die Base
Ammoniak und das Protonierungsprodukt Ammonium-Ion.
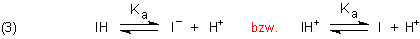
Die Extinktion bei einer bestimmten Wellenlänge ist vom pH-Wert abhängig.
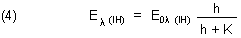
Dabei bedeuten
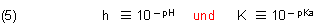
Das Gleiche gilt für die korrespondierende Indikatorbase.
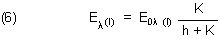
Die fotometrische Titrationskurve setzt sich aus den einzelnen Beiträgen der beiden Substanzen (korrespondierendes Säure/Base-Paar) zur Absorption des Lichts (Extinktion) zusammen. Daraus folgt die Funktion der fotometrischen Titrationskurve, die wir rot geschrieben haben.
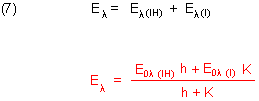
2 Zweibasige Indikatoren
Hier müssen wir neben einer Indikatorsäure und Indikatorbase noch einen Ampholyten
berücksichtigen. Die zwei Gleichgewichte sind
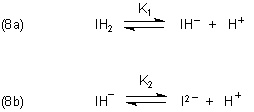
Die vom pH-Wert abhängigen Beiträge der drei Formen des Indikators zur Extinktion sind:
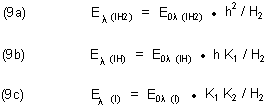
Dabei kürzen wir ab:
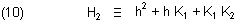
In diesen Gleichungen bedeuten:
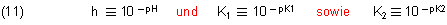
Die Funktion der fotometrischen Titrationskurve setzt sich aus den Einzelbeiträgen der drei Indikatorformen zusammen. Daraus folgt die Funktion der fotometrischen Titrationskurve, die wir rot geschrieben haben.
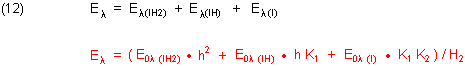
3 Dreibasige Indikatoren
Hierauf wollen wir nicht weiter eingehen. Der Algorithmus basiert ebenfalls auf denen der entsprechenden
Dissoziationsdiagramme.
Hinweis
Mathematische Programme zum Zeichnen dieser Kurven bringen wir hier.
Weitere Texte zum Phenolphthalein