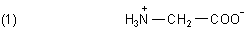
Der Isoelektrische Punkt (IEP) von Aminosäuren
Experimente:
Versuch: Reagiert Glycin sauer? (Isoelektrischer Punkt)
Die Elektrophorese von Elektrolyt-Lösungen stellt eine wichtige Methode zur Stofftrennung dar.
Dabei untersucht man, wie Ionen unter Einwirkung eines elektrischen Felds wandern. Man kann damit sogar
auf die Ladungen im Molekül schließen. Dazu muss man den pH-Wert der Lösung variieren. Bei den Aminosäuren
stieß man dabei auf den Effekt, dass bei einem bestimmten pH-Wert die Wanderung unterblieb. Die Moleküle
blieben förmlich "stehen". Diesen pH-Wert bezeichnet man als Isoelektrischen Punkt (IEP).
Er ist für die jeweilige Aminosäure eine spezifische Stoffkonstante.
Das Ausbleiben der Wanderung im elektrischen Feld kann nur dann eintreten, wenn die Zahl der Plus- sowie der Minus-Ladungen in einem Molekül gleich ist, es nach außen hin also ungeladen ist.
Hier haben wir so einen Fall. Es handelt sich um die Aminosäure Glycin.
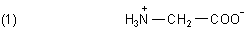
Man spricht von einem Zwitter-Ion. Das ist die Form, in der eine einfache Aminosäure vom Typ des Glycins im Kristall sowie in wässriger Lösung quantitativ vorliegt. (Wie so ein Zwitter-Ion real aussieht, beschreiben wir auf einer besonderen Webseite.)
Mit dieser Information im Kopf können wir den IEP auch ohne komplizierte Elektrolyse einfach bestimmen: Wir müssen nur eine Aminosäure wie Glycin in Wasser lösen (-> Versuch). Dann stellt sich der pH-Wert des IEP automatisch ein.
Dieser pH-Wert wird durch die folgende einfache Gleichung beschrieben.
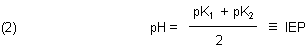
Wir betrachten die Dissoziation einer einfachen Aminosäure
Zwitter-Ionen sind Ampholyte, also Stoffe, die zugleich als Säure wie als Base wirken können.
Die Eigenschaft heißt amphoter. Andere Beispiele hierfür sind das Wasser sowie die Aquokomplexe
des Aluminiums.
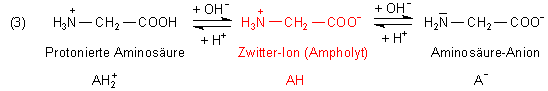
Damit die Aminosäure zu Beginn in der zweibasigen Form AH2+ vorliegt, muss sie in Salzsäure der gleichen Konzentration gelöst werden. (Oder man kauft gleich das Hydrochlorid der Aminosäure.) Erst dann können wir ihr Dissoziationsverhalten mit dem einer beliebigen zweibasigen Säure vom Typ AH2 vergleichen. (Zu deren Dissoziationsverhalten haben wir eine besondere Webseite.
Stellen wir uns eine Säure/Base-Titration einer protonierten Aminosäure vor: Ausgehend von AH2+ steigert man den pH-Wert. Im ersten Schritt bildet sich das Zwitter-Ion (AH). Dieses dissoziiert mit steigendem pH-Wert weiter zum Anion (A-). Folgende Gleichgewichte werden dabei durchlaufen.
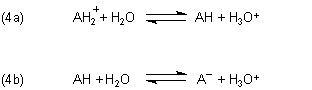
Die Gleichgewichtskonstanten sind (vereinfacht ohne das Wassersystem zu berücksichtigen):
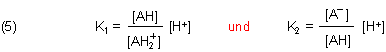
Durch Logarithmieren erhalten wir die beiden pKa-Werte.
Es wird immer wieder gefragt, wie man auf die verblüffend einfache Gleichung (2) zur Berechnung des Isoelektrischen Punkts kommt. Um das zu verstehen, benötigen die Dissoziationsdiagramme der drei an den Gleichgewichten beteiligten Spezies.
Diese Diagramme beruhen auf Funktionen, die sich aus den Definitionen der zwei Dissoziationskonstanten (5) herleiten lassen. Zur Berechnung der Funktionen klicke hier.
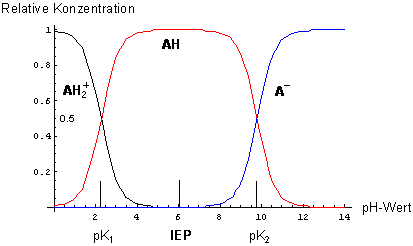
Dissoziationsdiagramm von protoniertem Glycin (pK1 = 2,27, pK2 = 9,78)
Es handelt sich um typische sigmoidale Gleichgewichtskurven. Man erkennt aus dem Verlauf
der Kurven die zwei Gleichgewichte (4a) und (4b): Zunächst bildet sich aus der zweibasigen Säure (fast) quantitativ der
Ampholyt, der dann im nächsten Gleichgewicht zum Anion wird.
Herleitung der Gleichung (2) für den IEP
Den pH-Wert des IEP kann man zunächst logisch erschließen: Die drei Dissoziationskurven sind symmetrisch
zum pH-Wert des Maximums der AH-Kurve. Das ist auch der pH-Wert der Lösung des Ampholyten. Es ist offenbar das
arithmetische Mittel der Summe der beiden pKa-Werte (-> Gleichung (2)).
Man kann den IEP aber auch wie folgt berechnen: Dazu greift man auf die beiden Gleichgewichtskonstanten in Gleichung (5) zurück und multipliziert sie.
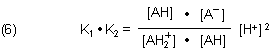
Mit der Randbedingung, dass die Konzentrationen der protonierten Säure AH2+ und des Anions A- im IEP gleich sind, und nach Wegkürzen von [AH] erhalten wir eine einfache Gleichung, die nach Logarithmieren zur Gleichung (2) führt.
Man kann drittens auch daran denken, die Funktion der Dissoziationskurve des Ampholyten nach pH zu differenzieren und das Differential gleich Null zu setzen, um das Maximum der Kurve und damit den pH-Wert des IEP zu ermitteln. Diese Rechnung ist aber ziemlich mühsam…
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“