Berechnung der Dissoziationsdiagramme schwacher zweibasiger Säure/Base-Systeme

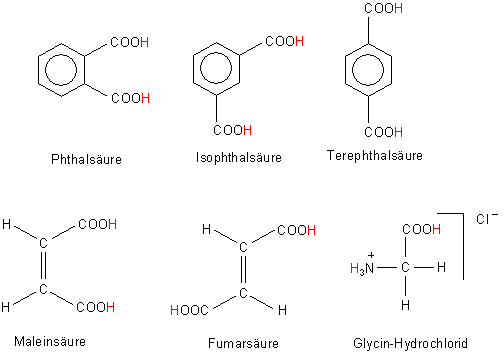
Strukturen einiger schwacher zweibasiger Säuren
Dissoziationsdiagramme zeigen uns den Verlauf der Konzentrationen der korrespondierenden Säure/Base-Paare in Abhängigkeit vom pH-Wert. Es sind echte Gleichgewichtskurven.
In einer anderen Webseite zeigen wir, wie man das Dissoziationsdiagramm für einbasige Säuren berechnet. Klicke hier. Diesen Text sollte man vorher anschauen.
Wir betrachten jetzt die Dissoziation einer zweibasigen Säure (AH2). Im ersten Schritt bildet sich ein Ampholyt (AH-), der dann weiter zum Di-Anion (A2-) dissoziiert. Ein Ampholyt ist ein Stoff, der gleichzeitig Säure und Base ist. Ein bekanntes Beispiel sind die Aminosäuren.
Bei der Herleitung der Funktionen zur Berechnung der Dissoziationsdiagramme gehen wir von einer vereinfachten Gleichgewichtsformulierung aus. Wir verzichten zum Beispiel auf die Beteiligung des Wassersystems. Statt mit Aktivitäten arbeiten wir mit Konzentrationen.
Die Reaktionsgleichungen sind folglich:
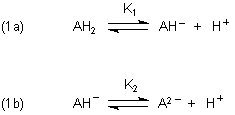
Die Gleichgewichtskonstanten sind so definiert:
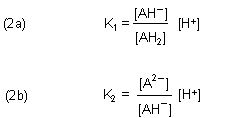
Wir teilen die Konzentrationen des korrespondierenden Säure/Base-Paars durch die Gesamtkonzentration und erhalten so die Relativkonzentrationen ri für die korrespondierenden Säure/Base-Paare. [H+] kürzen wir mit h ab.
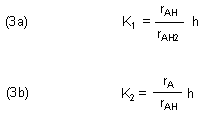
Mit der Konzentrationssumme

können wir die relativen Konzentrationen in Abhängigkeit vom pH-Wert ausrechnen. Zuerst berechnen wir die relative Konzentration der Säure AH2. Dazu gehen wir von der Gleichung (3a) aus. Die können wir erst mit Gleichung (4) kombinieren, wenn wir rA eliminiert haben.
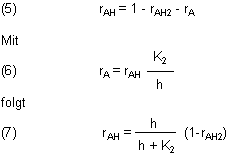
Das so berechnete rAH setzen wir in die umgebildete Gleichung (3a) ein. Daraus folgt durch einfache algebraische Operationen
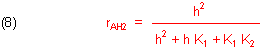
Zur Berechnung der relativen Konzentration des Ampholyten setzen wir die entsprechend umgestellte Gleichung (8) in die umgestellte Gleichung (3a) ein. Das Ergebnis ist:
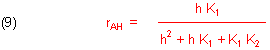
Die Konzentration der zweiten Base A2- berechnen wir, indem wir Gleichung (9) in Gleichung (3b) einsetzen. Es folgt:
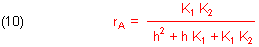
Die Gleichungen (8), (9) und (10) sind die Funktionen der drei Gleichgewichtskurven im Dissoziationsdiagramm. Zur Kontrolle kann man sie übrigens addieren. Dann erhalten wir Gleichung (4).
Wie führen wir den pH-Wert ein? Dazu müssen wir noch an die Definitionen von pH-Wert und der pKa-Werte denken.

Hier ist die Umsetzung der Gleichungen (8)-(10) in das Mathematikprogramm Mathematica®.

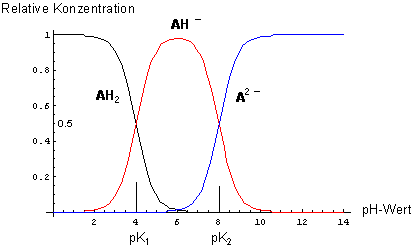
Dissoziationsdiagramm einer schwachen zweibasigen Säure (pK1 = 4, pK2 = 8)
Genau zwischen pK1 und pK2 liegt bei einfachen Aminosäuren wie Glycin
oder Alanin der Isoelektrische Punkt.
Wenn wir die Funktionen programmiert haben, können wir mit dem Gleichungssystem (8)-(10) „schön spielen“. Das betrifft vor allem die Konzentration des Ampholyten AH-.
Wenn die Differenz der pKa-Werte gering ist,...
… erreicht die relative Konzentration des Ampholyten nicht mehr den Wert 1. Dann überlappen alle drei Gleichgewichte stark.
So etwas kommt vor - zum Beispiel bei Isomeren der Phthalsäure oder bei anderen Dicarbonsäuren wie der Fumarsäure.
| pKa-Werte von schwachen zweibasigen Säuren | |||
| Säure | pK1 | pK2 | DpK |
| o-Phthalsäure | 2,90 | 5,36 | 2,46 |
| m-Phthalsäure (Isophthalsäure) |
3,53 | 4,60 | 1,07 |
| p-Phthalsäure (Terephthalsäure) |
3,54 | 4,34 | 0,80 |
| Maleinsäure | 1,92 | 6,23 | 4,31 |
| Fumarsäure | 3,02 | 4,38 | 1,36 |
| Glycin | 2,27 | 9,78 | 7,51 |
Die Konzentration der Ampholyte zu beachten ist vor allem für Berechnungen von Puffermischungen
sehr wichtig.
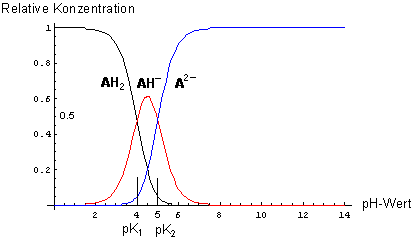
Dissoziationsdiagramm einer schwachen zweibasigen Säure mit geringer pKa-Wert-Differenz (pK1 = 4, pK2 = 5)
Wenn die beiden pKa-Werte weit auseinander liegen,…
… nähern sich die Kurven denen von einbasigen Säuren an. Dazu greifen wir wieder auf die Gleichungen
(8)-(10) zurück.
Nun müssen wir ein paar Annahmen machen. Im sauren Bereich ist der Term h2 viel größer als K1 • K2, so dass letzterer vernachlässigt werden kann. Damit kann Gleichung (10) für A2- entfallen. Man erhält dann zwei Gleichungen, deren rechte Seite durch h gekürzt wird. Auf diese Weise bilden AH2 und AH- formal ein unabhängiges einbasiges Säure/Base-Paar.
Im entgegengesetzten Bereich, also im Alkalischen, ist h2 viel kleiner als K1 • K2, so dass diesmal h2 vernachlässigbar klein ist. Damit entfällt die Gleichung (8) für AH2. Man erhält zwei Gleichungen, die durch K1 gekürzt werden können. Nun bilden AH- und A2- formal ein unabhängiges einbasiges Säure/Base-Paar.
Wenn man denn so will, kann man auch von pseudo-einbasigen Säure/Base-Systemen sprechen…
Wie das erst bei einer dreibasigen schwachen Säure mit geringen pKa-Wertdifferenzen aussehen muss! Die gibt es nicht? Doch - es handelt sich um die allseits bekannte Citronensäure. Zur Theorie dreibasiger Systeme klicke hier.
Dissoziationsgramme haben vieles gemeinsam mit Fotometrischen Titrationskurven.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“