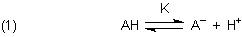
Berechnung der Dissoziationsdiagramme schwacher einbasiger Säure/Base-Systeme
Dissoziationsdiagramme zeigen uns den Verlauf der Konzentrationen der korrespondierenden Säure/Base-Paare in Abhängigkeit vom pH-Wert. Es sind echte Gleichgewichtskurven. Wenn man sie dreht, sind es letztlich Ausschnitte von Titrationskurven. Das zeigen wir hier am Beispiel der Essigsäure.
Bei der Herleitung der Funktionen zur Berechnung der Dissoziationsdiagramme gehen wir von einer vereinfachten Gleichgewichtsformulierung aus. Wir verzichten zum Beispiel auf die Beteiligung des Wassersystems. Statt mit Aktivitäten arbeiten wir mit Konzentrationen.
Die Reaktionsgleichung ist deshalb:
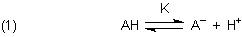
Die Gleichgewichtskonstante ist so definiert:
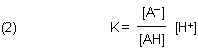
Wir teilen die Konzentrationen des korrespondierenden Säure/Base-Paars durch die Gesamtkonzentration und erhalten so die Relativkonzentrationen ri für das korrespondierende Säure/Base-Paar.
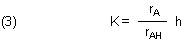
[H+] haben wir mit der Schreibweise h abgekürzt.
Mit der Konzentrationssumme

können wir die relativen Konzentrationen in Abhängigkeit vom pH-Wert ausrechnen. Dazu gehen wir von Gl. (3) aus.
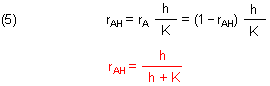
Mit Gleichung (4) berechnen wir den Anteil der korrespondierenden Base.

Die Gleichungen (5) und (6) sind die Funktionen der beiden Gleichgewichtskurven im Dissoziationsdiagramm.
Wie führen wir den pH-Wert ein? Dazu müssen wir noch an die Definitionen von pH-Wert und pKa-Wert denken.
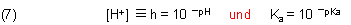
Hier ist die Umsetzung der Gleichungen (5) und (6) in das Mathematikprogramm Mathematica®.

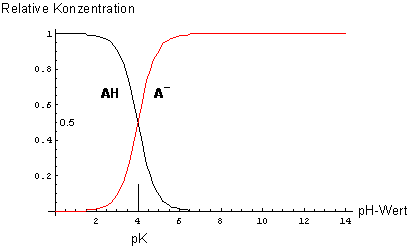
Dissoziationsdiagramm einer schwachen einbasigen Säure (pKa = 4)
Dissoziationsgramme haben vieles gemeinsam mit Fotometrischen Titrationskurven.
In einer anderen Webseite zeigen wir, wie man das Dissoziationsdiagramm für zweibasige schwache Säuren berechnet. Klicke hier.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“