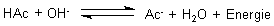
Zustandskurven chemischer Gleichgewichtssysteme sind
Wendepunktskurven
Experimente:
Versuch: Vergleich der Titrationskurven von Essigsäure und Salzsäure
Versuch: Säure/Base-Gleichgewichte und Pufferwirkung
Versuch: Ermittlung der Pufferkapazität in Abhängigkeit von der Konzentration
des zugesetzten Elektrolyten
Wir haben gesehen, dass sich Gleichgewichte durch äußere Einwirkungen
beeinflussen lassen. Man kann ihren Zustand beliebig verschieben, und
glücklicherweise gelingt das ohne Katastrophe, wenn man es nur geschickt anstellt.
Darüber berichtet das Le Chateliersche Prinzip
von der Minimierung des auf das System einwirkenden äußeren Zwangs.
Denn die Antwort auf eine Gleichgewichtsbeeinflussung erfolgt nämlich nicht im "Hauruck-Verfahren", indem das System total umkippt, sondern quasi schleichend. Mathematisch betrachtet haben wir es bei Kurven, die die Antwort von chemischen Gleichgewichtssystemen auf Störparameter darstellen, mit Wendepunktskurven zu tun. Je nach Art der Darstellung spricht man auch von sigmoidalen, also S-förmigen Kurven.
(Zur Erinnerung: Ganz anders ist es in der Informatik oder Digitaltechnik: Hier gibt es nur (+) oder (-), Ja oder Nein, und im binären Zahlensystem nur die Entscheidung zwischen den Ziffern 0 oder 1. Daraus folgt keine geschmeidige Wendepunktskurve, sondern eine sägezahnartige Kurvenabfolge.)
Wenn wir uns vergleichend die Titrationskurven einer starken und einer schwachen Säure ansehen, wird die Rolle von Wendepunkten deutlich (-> Versuch). Wir geben zu der weitgehend undissoziierten Essigsäure Natronlauge, und das System wird nicht (wie bei der unregelbaren starken Säure gleicher Konzentration) sofort alkalisch, sondern sein pH-Wert steigt nur langsam an (-> Versuch). Grund ist, dass das System dem äußeren Zwange entsprechend der Einwirkung ausweicht: Immer mehr Moleküle der Essigsäure dissoziieren.
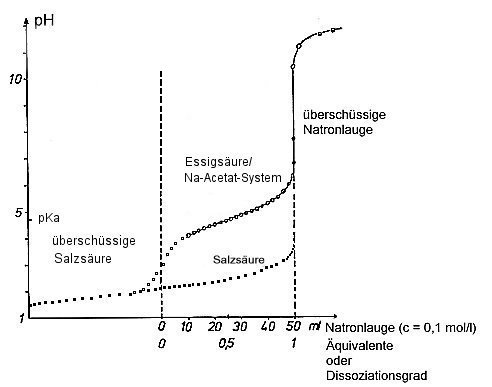
Bild 1: Titrationskurve der Essigsäure und der Salzsäure im Vergleich
Die sigmoidale Darstellung der Dissoziation heißt Dissoziationskurve. Diese Zustandskurven zeigt das folgende Bild. Man kann auf der Senkrechten über einem bestimmten pH-Wert den Zustand des Gleichgewichtssystems bestimmen, also die stoffliche Zusammensetzung ablesen.
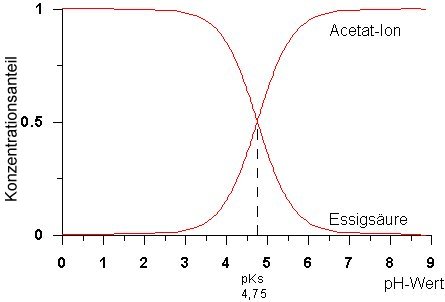
Bild 2: Dissoziationsdiagramm der Essigsäure
(Plot: Wolfgang B.)
Gleichgewichtssysteme reagieren also fast widerwillig, aber sie antworten fast logisch: Sie geben nur in dem Maße nach, wie sie gestört werden. Deshalb steigt der pH-Wert mit Zugabe an Natronlauge nur langsam an. In diesem Zusammenhang ist es sicherlich von Interesse, anhand einer Kurvendiskussion des Algorithmus eines schwachen Säure/Base-Systems, der Henderson-Hasselbalch-Gleichung, die Lage des Wendepunkts aufzuspüren. Er liegt dort, wo das System am trägsten ist, nämlich im Bereich größter Pufferung. Hier entscheidet das System, ob es unter minimalem Aufwand ins Saure oder Alkalische abgleitet.
Ein schönes Beispiel für eine sigmoidale Kurve bietet auch das Boudouard-Gleichgewicht, das beim Hochofen und Dieselmotor eine Rolle spielt.
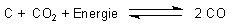
Gleichgewichtsbestimmend sind nur die Konzentrationen der Gase CO2 und CO.
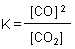
Trägt man deren Volumenanteile gegen die Temperatur auf, so resultiert die Kurve im folgenden Bild.
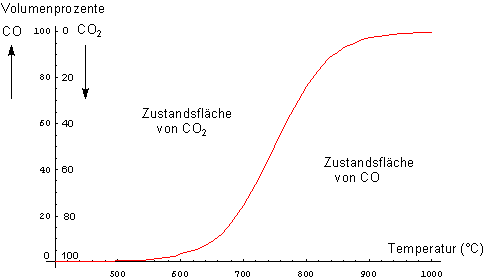
Bild 3: Volumenanteile von Kohlenstoffdioxid und Kohlenstoffmonoxid im Boudouard-Gleichgewicht (Druck 1,013 bar)
Die sigmoidale Gleichgewichtskurve trennt zwei Zustandsgebiete ("CO2" und "CO") voneinander:
Bei niedrigeren Temperaturen verschiebt sich das Gleichgewicht so, dass mehr CO2 vorliegt, bei
hohen Temperaturen nimmt der CO-Anteil zu.
Geht man zum Beispiel bei einer bestimmten Temperatur von einem Gemisch aus, dessen Zusammensetzung nicht
auf der Kurve, sondern im Bereich "CO2" liegt (zum Beispiel 20 % CO2 und 80 % CO bei 700 °C),
so nimmt in Gegenwart von Kohlenstoff die Konzentration von CO2 solange zu und die von CO ab, bis das
Volumenverhältnis erreicht ist, das die Gleichgewichtskurve für 700 °C vorgibt, also 80 % CO2 und 20 % CO.
Ähnliche Überlegungen gelten auch für andere Systeme wie zum Beispiel für die Reaktion des Kalkbrennens.
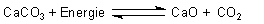
Die regelnde Rolle, die bei der Dissoziation von schwachen Säuren die äußere H+-Ionenkonzentration bzw. der pH-Wert spielen, übernimmt hier die Temperatur. Sie regelt die Konzentration bzw. den Druck des abspaltenden Kohlenstoffdioxids. Trägt man deshalb den CO2-Druck über dem erhitzten Kalk ("Dissoziationsdruck") gegen die Temperatur auf, so erhält man die der Dissoziationskurve analoge sigmoidale Kurve. Ein Hinweis: Meistens werden wie beim Kalkbrennen nur technisch interessante Ausschnitte der sigmoidalen Kurve gezeigt. Hier geht es um den Beginn der Zersetzung bis zum technisch realisierbaren Dissoziationsdruck des CO2, dem Atmosphärendruck.
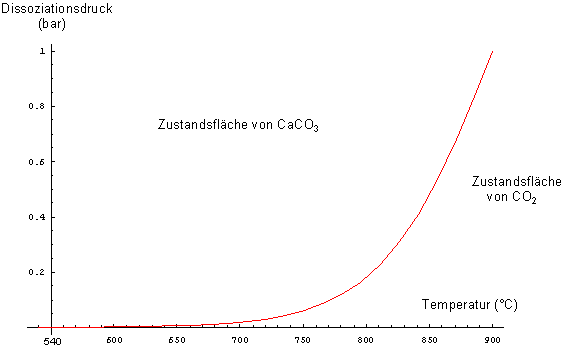
Bild 4: Technisch relevanter Ausschnitt aus der sigmoidalen Gleichgewichtskurve beim Kalkbrennen.
Als Konzentrationsmaß für das CO2 dient der Dissoziationsdruck von CaCO3
Bei anderen Gleichgewichten erhält man keine vollständige sigmoidale Kurve, weil das Gleichgewicht wegen zu hoher Temperatur wieder in die falsche Richtung geführt wird und der gebildete Stoff wieder zerfällt. Ein Beispiel hierfür ist das Gleichgewicht der "Luftverbrennung":
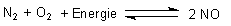
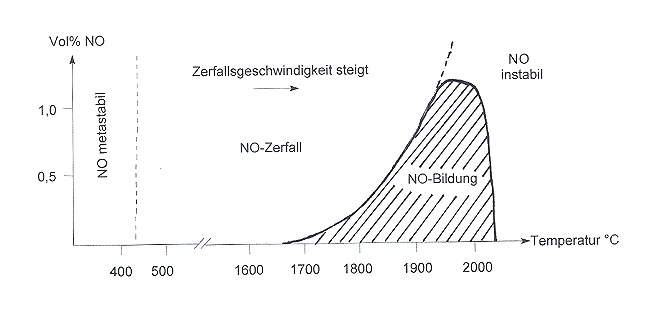
Bild 5: Gleichgewichtskurve der Luftverbrennung
(nach [5])
Mit dem flexiblen Wendepunktsprinzip werden chemische
Gleichgewichtssysteme von außen perfekt regelbar
Darin liegt die Bedeutung der chemischen Gleichgewichtssysteme für das Leben:
Nicht allzu grobe Einwirkungen auf die Organismen können auf diese Weise
elegant ausgeglichen werden. Übrigens werden auch viele Enzyme
auf diese Art und Weise kontrolliert. Wir sprechen von allosterischer
Regulation.
Wichtig ist dabei, dass man nicht die Grenzen des vom System Machbaren
überschreitet. Ein Beispiel hierfür ist die Pufferung. Gibt man
zuviel störende Säure oder Lauge zu einem Gleichgewichtssystem (->
Versuch), überschreitet man also seine Pufferkapazität, so kippt das
System ins entsprechende Extrem: Es wird zu sauer oder zu alkalisch. Biologische
Systeme überleben solche Ausflüge ins Extreme erstaunlich gut. Auch hier sind bei
manchen Systemen die Grenzen eng gesteckt. Weicht beispielsweise der arterielle
Blut-pH-Wert von normalen 7,37-7,45 über längere Zeit hinweg nur um plus/minus
0,1 Einheiten ab, so machen sich lebensbedrohliche Syndrome (Acidose bzw.
Alkalose) bemerkbar. Größere, alimentär bedingte kurzfristige Abweichungen sind
nicht gefährlich. Dagegen hat unser Organismus ein ausgefeiltes Puffersystem
entwickelt. Es handelt sich vor allem um das sich ständig regenerierende
CO2/Wasser-System. Dessen Wirkung beruht nicht so sehr auf seiner Konzentration
(also auf seiner Pufferkapazität, sondern vor allem darauf, dass
wir ständig CO2 ausatmen und so aus dem Puffergleichgewichtssystem entfernen.
Die Effektivität des Blutpuffersystems konterkariert den modischen Übersäuerungs-Schnickschnack
von Leuten, die sich um ökologisch bewusste Ernährung bemühen.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“