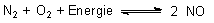
Die Luftverbrennung
Experimente:
Versuch: Luftverbrennung
Versuch: Luftverbrennung in einer Kerzenflamme
Bei der so genannten Luftverbrennung reagieren Stickstoff und Sauerstoff unter Bildung von Stickstoffoxiden
(auch Stickoxide genannt) (-> Versuch).
Schon die Hitze einer Kerzenflamme
(-> Versuch) reicht zur Bildung von
Stickoxiden aus. Zunächst ensteht Stickstoffmonoxid NO. Dabei handelt es sich um ein endothermes Gleichgewicht.
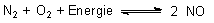
Dieses Gleichgewicht liegt sehr ungünstig, wie der folgenden Tabelle zu entnehmen ist:
| t °C | Vol% |
| 200
700 1200 1800 1900 |
10-7
0,04 0,1 0,5 1 |
Als endotherm gebildete Substanz sollte das NO bei Verlassen der heißen Räume sofort wieder zerfallen. Dass das nicht geschieht, liegt daran, dass der Zerfall von NO unterhalb von 450 °C stark gehemmt ist und eine hohe Aktivierungsenergie erfordert. NO ist also metastabil. Das ist die Ursache für das Umweltproblem, das uns der Betrieb von Kfz beschert. Andererseits erkennen wir den Lösungsweg für das Problem: Wir müssen die Aktivierungsenergie senken - durch Katalysatoren. Dies ist die Grundlage für die Verfahren zur Kfz-Abgasreinigung.
Dass der Prozess der Luftverbrennung endotherm ist, hat auch zur Folge, dass NO nicht unermesslich entstehen kann. Die Faustregel "Je höher die Temperatur, desto mehr NOx bildet sich" stimmt nur bis 1900 °C. Bei höherer Verbrennungstemperatur wird die Aktivierungsenergie zum exothermen Zerfall von NO überschritten. Folglich nimmt die NO-Bildung bei Temperaturen über 1900 °C wieder ab. Dies zeigt die folgende Graphik.
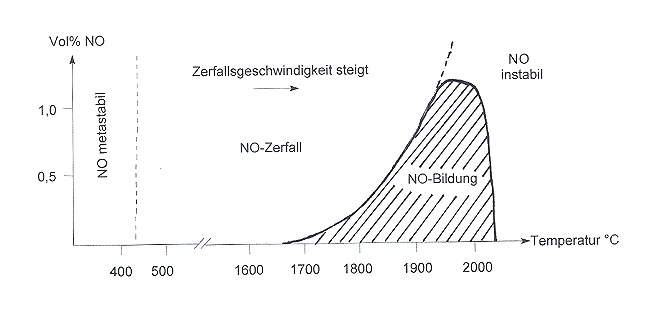 |
| Bildung und Zerfall von Stickstoffmonoxid NO (nach Holleman und Wiberg) |
Wenn ausreichend Sauerstoff vorhanden ist, reagiert das farblose NO rasch weiter zu braunem
Stickstoffdioxid NO2, diesmal in einer exothermen Reaktion.
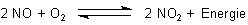
Das wiederum steht mit farblosem Distickstofftetroxid im Gleichgewicht.
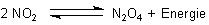
(Zu diesem Gleichgewicht haben wir eine besondere Webseite.)
Durch all diese Anschlussgleichgewichte verschiebt sich das Gleichgewicht der Luftverbrennung ständig in Richtung auf Bildung von NO. Damit sind auch die großen Mengen an Stickoxiden, die bei Verbrennungsprozessen entstehen, zu erklären.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“