 |
 |
 |
 |
 |
| Bild 1: Für die Menschheit wichtige Eisenquellen: Meteoreisen und Eisenerze (Schwefeleisen,
Hämatit, Limonit und Bohnerz, Magnetit)
(Fotos: Blume) |
Eisen und Stahl
 |
 |
 |
 |
 |
| Bild 1: Für die Menschheit wichtige Eisenquellen: Meteoreisen und Eisenerze (Schwefeleisen,
Hämatit, Limonit und Bohnerz, Magnetit)
(Fotos: Blume) |
Experimente:
Versuch: Experimente mit Magneteisenerz
Versuch: Rösten von Pyrit
Versuch: Reduktion von Eisenoxid mit Kohle
Versuch: Nachweis von Kohlenstoff in Eisen und Stahl
Versuch: Schmiedeverhalten von Gusseisen und von Stahl
Versuch: CO reduziert Eisenoxid.
Eisen ist das wichtigste Metall überhaupt. Seine Produktion hängt eng mit der
Wirtschaftskraft eines Landes zusammen. Für 2003 erwartet man für Deutschland (wie auch im letzten Jahr)
eine Produktion von 45 Millionen Tonnen Stahl. Weltweit sollen etwa 940 Millionen Tonnen hergestellt
werden. Grund für die hohen Zahlen ist nicht nur Neuproduktion von Metallwaren, sondern zum großen Teil
auch der Ersatz von Korrosionsschäden.
Man gewinnt das Metall aus Erzen wie Magneteisenerz Fe3O4 (Magnetit)
und Pyrit.
Pyrit wird durch Erhitzen an der Luft (Rösten) in Eisenoxid Fe2O3 überführt (->
Versuch), das dann im Hochofen mit Kohle bzw.
Kohlenstoffmonooxid reduziert wird (-> Versuch):
4 FeS2 + 11 O2 ———> 2 Fe2O3 + 8 SO2
2 Fe2O3 + C ———> 4 Fe + 3 CO2
Genau genommen ist CO das eigentliche Reduktionsmittel (->
Versuch):
Fe2O3 + 3 CO ———> 2 Fe + 3 CO2
Ein Teil des CO2 wird an die Atmosphäre abgegeben. Der Rest dient zur Rückbildung von CO mit glühender Kohle:
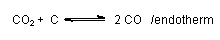
Diese Symproportionierungsreaktion ist ein chemisches Gleichgewicht (Boudouard-Gleichgewicht). Es spielt auch bei den Dieselmotoren eine wichtige Rolle.
Insgesamt laufen im Hochofen (vereinfacht dargestellt) folgende Reaktionen ab:
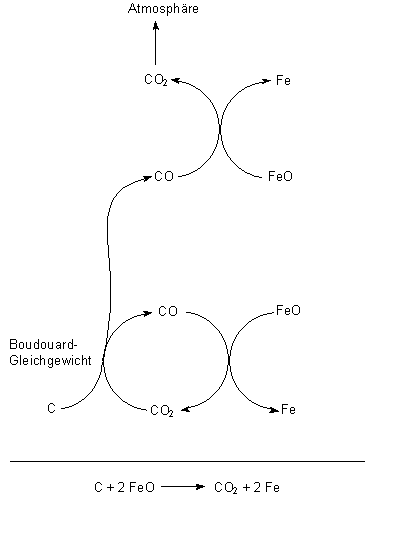
Reines Eisen selbst ist sehr weich (wie du z. B. am Blumendraht sehen kannst). Durch
Zusatz von Kohlenstoff wird es gehärtet und zu Stahl.
Deshalb kannst du in Stahl leicht Kohlenstoff nachweisen (-> Versuch).
Es bilden sich hellfarbene Eisen-Kohlenstoffverbindungen. Bei zu hohem Anteil an
Kohlenstoff bilden sich Graphitnester, das Eisen wird dunkelgrau. Dazu verliert es seine
elastischen Eigenschaften und wird zu billigem Gusseisen. Die
Eigenschaften äußern sich im unterschiedlichen Verhalten beim Schmieden
(-> Versuch).
Übrigens wird der Kohlenstoffgehalt durch das Schmieden beeinflusst. Zunächst brennt
der Schmied den Kohlenstoff heraus. Durch Einbringen in die Holzkohlenglut wird das
Stück wieder "aufgekohlt". Ist das Stück in der richtigen Form, wird es durch
Abschrecken gehärtet, d.h. sein Kohlungszustand und seine Eisen-Kohlenstoffverbindungen werden eingefroren: Das Eisen ist zu Stahl geworden.
Dieses Aufkohlen erfolgt auch durch Eintauchen in Blut, Urin und was die Sagen und
Legenden sonst noch berichten. Hierbei wird auch deutlich, dass sogar der Stickstoff
eine Härtung bewirkt. Deshalb nutzt man in der Drucktechnik zum Härten von
Weicheisen, in das die Urstöckel z. B. von Briefmarken graviert wurden, Cyanide wie
Kaliumcyanid. Dessen Formel KCN zeigt, was man zum Härten braucht: Kohlenstoff
und Stickstoff.
Des Weiteren fügt man dem Stahl noch andere Metalle zu und erhält Legierungen, die noch wesentlich bessere Eigenschaften haben als einfacher Stahl. Es bilden sich nicht nur Mischungen (oder feste Lösungen) von Metallen, sondern auch intermetallische Verbindungen, die dem Stahl ganz besondere Festigkeit verleihen.
Stahl spielt z. B. als Material für die Kugellager eine wichtige Rolle. Überlege, welch ein Druck auf einem Punkt der Kugel lastet!

Bild 2 (Foto: Blume)
Zur genaueren Betrachtung der Hochofenprozesse unter dem Aspekt des chemischen
Gleichgewichts haben wir eine besondere Webseite
erstellt.
Die Rolle der Carbide
Die zentrale Rolle bei der Entstehung von Stahl spielt Eisencarbid Fe3C mit dem
treffenden Namen Zementit. Der bildet sich, wenn Eisen(oxid) mit Koks erhitzt wird.
Zementit bildet mit Eisen feste Mischungen, deren Aufbau von der Temperatur und der Abkühldauer abhängt:
| - | Beim Erhitzen auf etwa 800 °C wird Zementit wieder in freies Eisen und Kohlenstoff zerlegt. Diese feste, metallartige Mischung heißt Austenit. Nun beginnt der Schmied mit Hilfe von Hammerschlägen, den Kohlenstoff zu entfernen. |
| - | Wenn der Schmied anschließend den Austenit plötzlich durch Eintauchen in Wasser oder Öl abkühlt („abschreckt“), bleiben Eisen und freier Kohlenstoff in Form von Einlagerungscarbiden auch bei tiefer Temperatur als feste Lösung nebeneinander erhalten. Der Zustand (genannt Martensit) wird quasi eingefroren. |
Die auf diese Weise in einander verfilzten Kristalle der unterschiedlichen „Phasen“ verleihen dem so entstandenen Stahl seine bekannte Schmiedbarkeit, Zähigkeit und Festigkeit.
Knautschzonen aus Stahl
Wenn es einen Zusammenstoß gibt, sieht ein Auto dementsprechend zerknautscht aus. Denn
zum Verformen von Stahl ist viel Energie aufzuwenden. So wird die kinetische Energie der
zusammenstoßenden Fahrzeuge aufgefangen - oder besser gesagt: umgewandelt.

Bild 3: Auch Metall kann zerknautschen wie Papier...
(Foto: Blume)
Allerdings ist normaler Stahl selbst wenig verformbar und deshalb so elastisch, dass die
Stoßenergie nicht aufgefangen werden kann. Sie wandelt sich voll in kinetische Energie um, so
dass wie unter der Wirkung einer Stahlfeder die Insassen des Autos herumgeschleudert werden.
Wenn man aber weichere Stahlsorten nimmt und diese beim Zusammensetzen der Bleche zugleich noch geschickt anordnet, wird beim Zusammenstoß die kinetische Energie eher zur Metalldeformation genutzt und dabei letztlich in Wärme umgewandelt. Diese Bleche spielen die Rolle von Energiepuffern. Allerdings wird dabei das Auto deutlich stärker „geschrottet“ (verformt) als es bei hartem Blech der Fall wäre - aber die Insassen werden weniger verletzt.
Die Fahrgastzelle jedoch wird weiterhin aus besonders hartem Stahl gefertigt - denn die sollte sich nur möglichst wenig verformen!
Weitere Texte zum Thema „Auto“