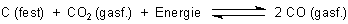
Boudouard-Gleichgewicht: Zentrale Reaktion der Kohle
Experimente:
Klicke hier
Die folgende Gleichung beschreibt das Boudouard-Gleichgewicht.
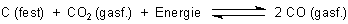
Es handelt sich um eine Symproportionierung (auch Komproportionierung genannt)
zwischen CO2 und C. Rückwärts betrachtet handelt es sich um eine Disproportionierung.
O. L. Boudouard war übrigens ein französischer Chemiker, der sich 1905 mit dieser Reaktion beschäftigte.
Am Beispiel des Boudouard-Gleichgewichts lässt sich das Prinzip von Le Chatelier gut erklären, dem zufolge man ein Gleichgewicht durch Änderung von Druck, Temperatur und Konzentration der Reaktanden beliebig verschieben kann, wobei alle Parameter mehr oder weniger voneinander abhängen.
Man muss sich bei den folgenden Erörterungen immer darüber im Klaren sein, dass ausreichend fester Kohlenstoff vorhanden sein muss.
Druck
Die Lage des Boudouard-Gleichgewichts hängt vom Druck ab, da die Gas-Molzahlen auf den beiden Seiten der
Reaktionsgleichung unterschiedlich sind. Mit steigendem Druck verschiebt sich das Gleichgewicht auf die Seite
von C und CO2.
Temperatur
Das Gleichgewicht ist abhängig von der Temperatur, weil die Reaktion zwischen C und CO2 endotherm
ist. Trägt man die Volumenanteile der Gase gegen die Temperatur auf, so resultiert die für Gleichgewichte typische
sigmoidale Wendepunktskurve im folgenden Bild.
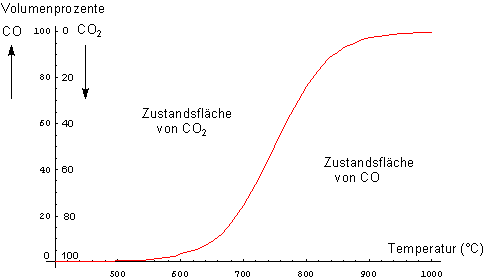
Volumenanteile von Kohlenstoffdioxid und Kohlenstoffmonoxid im Boudouard-Gleichgewicht (Druck 1,013 bar)
Die Gleichgewichtskurve trennt zwei Zustandsgebiete ("CO2" und "CO") voneinander.
Im CO-Gebiet bildet sich CO aus C und CO2; im CO2-Gebiet zerfällt CO wieder zu C und CO2.
Anders gesagt: Bei niedrigeren Temperaturen verschiebt sich das Gleichgewicht so, dass mehr CO2 vorliegt. Bei
hohen Temperaturen nimmt der CO-Anteil zu.
Geht man zum Beispiel bei einer bestimmten Temperatur von einem Gemisch aus, dessen Zusammensetzung nicht auf der Kurve, sondern im Bereich "CO2" liegt (zum Beispiel 20 % CO2 und 80 % CO bei 700 °C), so nimmt die Konzentration von CO2 solange zu und die von CO ab, bis dasjenige Volumenverhältnis erreicht ist, das die Gleichgewichtskurve für 700 °C vorgibt, also 80 % CO2 und 20 % CO.
Bei 400 °C liegt das Gleichgewicht praktisch vollständig auf der Seite des CO2 und oberhalb von 1000 °C auf der Seite von CO. Dass CO trotzdem auch in der Kälte stabil bleibt, liegt daran, dass zur Umwandlung in CO2 und C eine beträchtliche Aktivierungsenergie aufzubringen ist; CO ist somit bei niedrigen Temperaturen metastabil.
Konzentrationen
Bei den Konzentrationen (besser: Aktivitäten) sind nur diejenigen der Gase CO2 und CO für die Lage des
Gleichgewichts bestimmend, da die Aktivität des festen Kohlenstoffs als konstant angesehen und gleich Eins gesetzt wird.
Der folgende Ausdruck beschreibt die Gleichgewichtskonstante für das Boudouard-Gleichgewicht.
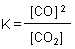
Diese Konstante ist (wie man in der Abbildung sieht) abhängig von der Temperatur. Obwohl es sich um eine Reaktion
zwischen Gasen handelt, ist sie aber - wie alle Gleichgewichtskonstanten - unabhängig vom Druck. Vom Druck abhängig ist
nur die Lage des Gleichgewichts. Hier berichten wir darüber.
Beispiele für die Anwendung des Boudouard-Gleichgewichts
Das Gleichgewicht spielt eine Rolle bei Verfahren zur Herstellung von Ruß.
Es ist außerdem wichtig für das Verständnis der Vorgänge beim Hochofenprozess und erklärt, warum letztlich CO und nicht Kohle/Koks das Reduktionsmittel für Eisenoxide ist.
Aber auch die Frage, warum Dieselmotoren kaum CO, aber dafür Ruß ausstoßen, lässt sich anhand dieses Gleichgewichts verstehen. Bei letzterem muss man vor allem die Druckabhängigkeit des Boudouard-Gleichgewichts beachten.